Cognitive FX-behandeling voor aanhoudende klachten na een hersenschudding: Observatie van verandering in functioneren
Samenvatting
Introductie
De Cognitive FX (CFX)-behandeling voor aanhoudende klachten na een hersenschudding is een intensieve behandeling van een week die wordt gekenmerkt door een herhalende cyclus van cardiovasculaire activiteit, revalidatietherapie en ontspanningsoefeningen. In Nederland is veel aandacht voor CFX, maar de effectiviteit van de behandeling is onbekend. Dit onderzoek brengt veranderingen in kaart bij mensen die de CFX-behandeling ondergaan, op het gebied van symptoomlast, psychologisch functioneren, vestibulair-oculair functioneren, neurocognitieve functies, balans, algemeen functioneren en participatie.
Methode
Het functioneren van 64 deelnemers werd gemeten met vragenlijsten en multidisciplinaire metingen voor, direct na en zes maanden na de behandeling. Verandering in het functioneren werd getoetst met t-toetsen en reliable change indexen. Met een multipele regressieanalyse werden factoren onderzocht die samenhangen met verandering in symptoomlast.
Resultaten
De symptoomlast van deelnemers was na de behandeling significant lager, een betekenisvolle afname werd gezien bij 77% van de deelnemers. Er was daarnaast sprake van een afname in zelfgerapporteerde angst, depressie, vermoeidheid en slaapproblemen. Verbeteringen werden ook geobserveerd in het vestibulair-oculair functioneren, het neurocognitief functioneren en in participatie. Een hogere mate van vermoeidheid en een minder verantwoordelijkheidsgevoel waren gerelateerd aan een sterkere afname in symptoomlast.
Discussie
De CFX-behandeling gaat gepaard met verbeteringen in het functioneren in symptoomlast, psychologisch functioneren, prestatietests voor vestibulair-oculair functioneren en neurocognitieve functies, en de mate van participatie. De resultaten bieden geen directe evidentie voor effectiviteit vanwege het ontbreken van een gerandomiseerd onderzoeksdesign.
Inleiding
Traumatisch hersenletsel komt wereldwijd voor bij naar schatting 54 tot 60 miljoen mensen per jaar, waarvan in Nederland jaarlijks 80.000 gevallen worden geregistreerd (Feigin e.a., 2013; Veiligheid.nl, 2013). Ongeveer 90% betreft licht traumatisch hersenletsel, oftewel een hersenschudding (Boyle e.a., 2014). Hersenschuddingen gaan gepaard met acute symptomen van zeer diverse aard, waaronder klachten van hoofdpijn, duizeligheid, misselijkheid, balans, zicht, visus, cognitie, slaap en emoties (Boyle e.a., 2014). De acute symptomen herstellen in de meeste gevallen binnen enkele dagen tot weken volledig, maar bij 10 tot 30% van de mensen houden de klachten langer dan drie maanden aan (Boyle e.a., 2014). Aanhoudende klachten kunnen leiden tot ernstige beperkingen in het dagelijks functioneren (De Koning e.a., 2015).
Momenteel zijn er geen evidence-based curatieve behandelingen beschikbaar voor aanhoudende klachten na een hersenschudding (Nederlandse Vereniging voor Revalidatieartsen, 2023). De afgelopen jaren is de belangstelling toegenomen voor een specifiek behandelcentrum in de Verenigde Staten, Cognitive FX (CFX). Veelbelovende patiëntervaringen circuleren op de sociale media en naar verluidt reizen jaarlijks honderden Nederlandse patiënten naar deze kliniek. Deze situatie is problematisch vanuit maatschappelijk oogpunt, omdat weinig bekend is over de inhoud van de behandeling, de behandeling kostbaar is (11.000 tot 15.000 euro), niet vergoed wordt en daardoor niet goed toegankelijk is, en de effectiviteit niet wetenschappelijk onderzocht is.
Volgens CFX is de behandeling gericht op het herstellen van verstoringen in de zuurstofafgifte aan actieve hersengebieden (Wing e.a., 2017). De kern van de behandeling bestaat uit een cyclus van (1) cardiovasculaire activiteit; (2) een combinatie van cognitieve, psychosociale, vestibulair-oculaire en sensorische training en (3) rustoefeningen (Wing e.a., 2017). De standaardbehandelduur is één week, waarbij deze cyclus meerdere keren per dag wordt herhaald. Voor en na de behandeling wordt een functionele MRI-scan verricht tijdens het uitvoeren van cognitieve taken, waarbij afwijkingen in de zuurstofafgifte aan hersengebieden worden weergegeven met een door CFX zelf ontwikkelde score.
Tot op heden zijn aanwijzingen voor effectiviteit van de CFX-behandeling beperkt tot positieve ervaringen van patiënten en observationeel onderzoek uitgevoerd door CFX zelf. CFX rapporteert een afname in de mate van afwijkende zuurstofafgifte in de hersenen met gemiddeld 75% tijdens de behandeling, op basis van niet-onafhankelijk en ongecontroleerd onderzoek (Wing e.a., 2017). In een vragenlijst van het Universitair Medisch Centrum Groningen (UMCG) onder een convenience sample van 76 Nederlandse patiënten met niet-aangeboren hersenletsel, rapporteerde een grote meerderheid (94%) verbetering in de klachten na de behandeling bij CFX (Groenewold & Verheij, 2019).
Het schaarse onderzoek naar de CFX-behandeling laat dus veelbelovende resultaten zien, maar heeft belangrijke methodologische beperkingen. Daarbij strookt de theoretische onderbouwing van de behandeling niet met de meest recente literatuur, waar wordt verondersteld dat aanhoudende klachten na een hersenschudding mogelijk ontstaan door een complex samenspel van neurologische en psychologische mechanismen (Clark e.a., 2022). Bovendien blijft theoretisch onduidelijk hoe de specifieke combinatie van cardiovasculaire activiteit en cognitieve training gericht lokale verstoringen in de zuurstofafgifte aan hersengebieden kan herstellen, zoals verondersteld door CFX (Wing e.a., 2017). Al met al bestaat er dus aanzienlijke onzekerheid over de onderbouwing, inhoud en effectiviteit van de behandeling.
Gezien de populariteit van de behandeling onder Nederlandse patiënten, is onafhankelijk onderzoek naar de waarde van de CFX-behandeling van belang. De huidige studie heeft als doel om veranderingen in het functioneren in kaart te brengen bij mensen die op eigen initiatief de behandeling van CFX ondergaan in de Verenigde Staten, zowel op de korte als op de langere termijn. Daarbij wordt ook onderzocht welke factoren samenhangen met de verandering in gerapporteerde symptoomlast.
Methoden
Studieopzet en populatie
Dit is een prospectieve longitudinale observationele studie. De populatie betrof mensen die op eigen initiatief de behandeling bij CFX ondergingen voor aanhoudende klachten na een hersenschudding. De inclusiecriteria waren: (1) tussen de 18 en 65 jaar; (2) aanhoudende klachten na een hersenschudding (Glasgow Coma Scale score 15-13, bewustzijnsverlies minder dan dertig minuten, anterograde posttraumatische amnesie minder dan 24 uur (Teasdale & Jennett, 1974); (3) ingepland voor een CFX-behandeling in Utah, ten minste twaalf maanden na het letsel om de mogelijke bijdrage van spontaan herstel in de huidige studie te minimaliseren (Nelson e.a., 2019). Potentiële deelnemers met een voorgeschiedenis van neurologische aandoeningen (elke neurologische diagnose anders dan een hersenschudding) werden uitgesloten van deelname.
Meetinstrumenten
Karakteristieken en het functioneren van deelnemers werden in kaart gebracht aan de hand van herhaalde vragenlijsten en multidisciplinaire metingen die staan weergegeven in Tabel 1 (zie p. 115 e.v.). Samengevat bestaat het onderzoek uit: (1) een intakevragenlijst om de demografische en medische achtergrond van deelnemers, persoonskenmerken en kenmerken van hun hersenschudding in kaart te brengen; (2) vragenlijsten om de perceptie van functioneren in kaart te brengen en (3) een multidisciplinaire meting om het functioneren met prestatietests in kaart te brengen op het gebied van vestibulair-oculair functioneren, neurocognitieve functies en statische en dynamische balans. De metingen werden afgenomen op verschillende momenten: T0: voorafgaand aan de behandeling, T1: één week na de behandeling; T2: één maand na de behandeling; T3: zes maanden na de behandeling (zie Figuur 1, p. 115). De symptoomlast gemeten met de Sports Concussion Assessment Tool – 5th edition (SCAT5) fungeerde als primaire uitkomstmaat.
Procedure
Informatie over het onderzoek werd verspreid via internet en sociale media, waaronder de kanalen van de Hersenstichting, Stichting Hersenschudding, Patiëntenvereniging Hersenletsel.nl en bestaande Facebookgroepen van mensen die geïnteresseerd zijn in de behandeling van CFX. Voor deelname werd schriftelijke toestemming verkregen. Deze studie is goedgekeurd door de METC van het Amsterdam UMC (#NL76945.018.21).
Analyse
De statistische analyses werden uitgevoerd met behulp van R (versie 4.2.1). Outliers (M±3SD) werden zo nodig herschaald met winsorizing. Variabelen met minder dan 10% ontbrekende waarden werden geïmputeerd met predictive mean matching. De analyse geschiedde volgens het 'intention to treat'-principe.
Om verandering in het functioneren van deelnemers te onderzoeken werd een gepaarde t-toets gebruikt om: (1) kortetermijnverandering te toetsen (T0 vs. T2); (2) langetermijnverandering te toetsen (T0 vs. T3) en (3) verandering in de periode na de behandeling te toetsen (T2 vs. T3). Daarnaast werd voor iedere deelnemer op elke uitkomstmeting bepaald of er sprake was van betekenisvolle verandering aan de hand van een reliable change index die per uitkomstmeting werd berekend aan de hand van een significantieniveau van alpha = ,05 (Christensen, 1986). Op basis van kans wordt dan bij 5% van de deelnemers een betekenisvolle verandering verwacht, waarvan dit bij 2,5% van de deelnemers een verbetering betreft. Met een chi-kwadraattoets werd bepaald of de proportie deelnemers met betekenisvolle vooruitgang significant groter was dan op basis van kans zou worden verwacht (2,5%). Tot slot werd aan de hand van een multipele regressie met backwardselectie onderzocht welke factoren verklarend waren voor de symptoomlast bij aanvang van de behandeling (SCAT5 op T0) en de mate van verandering in symptoomlast op één maand na de behandeling (SCAT5 T2-T0). Daarbij werd gebruikgemaakt van verschillende sets van variabelen (predictorsets) die samen als predictoren in multipele regressie werden gebruikt: demografische en medische achtergrond (sekse, leeftijd, opleidingsniveau, leerstoornis, psychiatrische stoornis), kenmerken hersenschudding (eerdere hersenschudding, bewustzijnsverlies, anterograde PTA, overgeven, maanden sinds letsel), persoonskenmerken (persoonlijkheidskenmerken en copingstijlen), functioneren bij aanvang (angst, depressie, vermoeidheid, slaapproblemen). Per predictorset werd een aparte regressieanalyse uitgevoerd. Vervolgens werden alle predictoren uit deze sets gezamenlijk opgenomen in een aparte regressieanalyse. Alle statistische tests waren tweezijdig met een significantieniveau op p < ,05. Voor alle vergelijkingen per statistische toets (t-toets of chi-kwadraattoets) werd één FDR-correctie voor multipele tests toegepast. Effectgroottes werden uitgedrukt in Cohen's d en geïnterpreteerd als een klein effect (0,2 ≤ d < 0,5), middelgroot effect (0,5 ≤ d < 0,8) of een groot effect (d ≥ 0,8; Cohen, 1988).
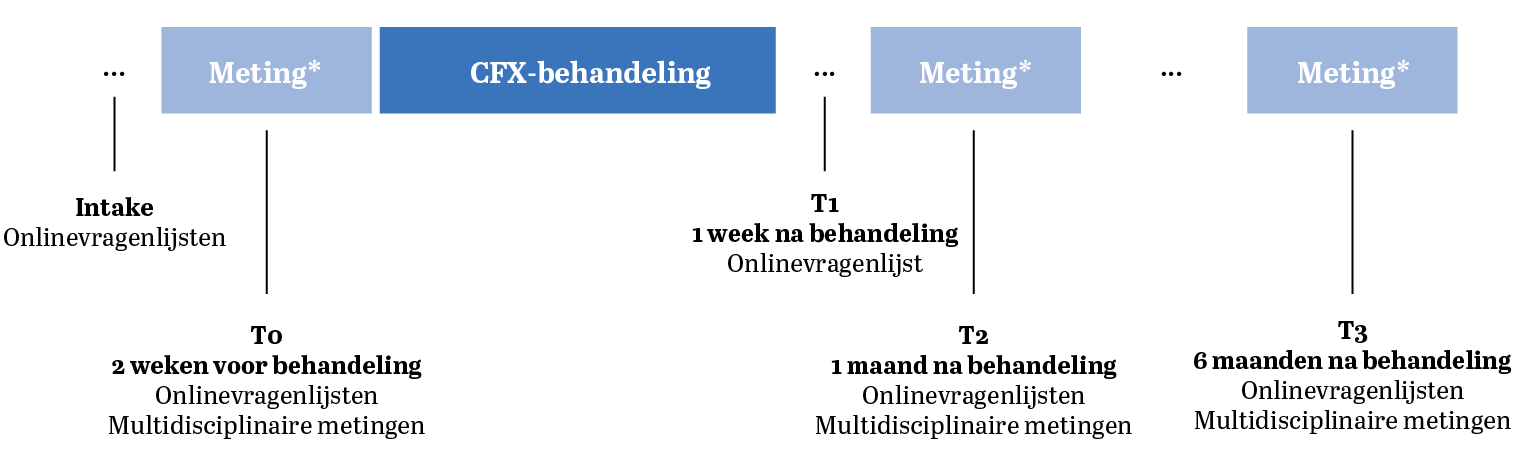
Figuur 1 Metingen over de tijd. (Multidisciplinaire metingen vonden plaats in het Sportmedisch Centrum van de KNVB in Zeist. Als deelnemers niet in staat waren om te reizen, dan werden de metingen afgenomen tijdens een huisbezoek.)
Tabel 1 Meetinstrumenten
| Type meting | Meetmoment | Domein | Meetinstrument | Beschrijving |
|---|---|---|---|---|
| Onlinevragenlijsten | Intake | Demografische en medische achtergrond | Zelf samengestelde vragenlijst | Uitgebreide achtergrondinformatie, inclusief demografische gegevens, medische geschiedenis en behandelgeschiedenis. Opleidingsniveau werd gedefinieerd als het hoogste niveau van de huidige of afgeronde opleiding, variërend van 1 (geen opleiding) tot 8 (postdoctoraal onderwijs) volgens de standaardonderwijsindeling van het Centraal Bureau voor de Statistiek. |
| Intake | Verwachtingen | Zelf samengestelde vragenlijst | Verwachtingen met betrekking tot de behandeling werden geëvalueerd aan de hand van vijf vragen, beoordeeld op een schaal van 0 (lage verwachtingen) tot 100 (hoge verwachtingen). De gemiddelde score van deze vijf vragen werd als de totaalscore gehanteerd. | |
| Intake | Persoonlijkheidsstructuur | Severity Indices of Personality Problems – Short Form (SIPP-SF) (Verheul e.a., 2008) | De SIPP-SF brengt persoonlijkheidskenmerken in kaart en bestaat uit zestig items en omvat vijf subschalen. De volgende vijf schalen worden onderscheiden: Zelfcontrole (emotieregulatie, controle), Identiteitsintegratie, Verantwoordelijkheid, Relationele capaciteiten en Sociale concordantie. Elk item wordt gescoord op een 4-punt Likertschaal van 1 (volledig mee oneens) tot 4 (volledig mee eens). Lagere scores zijn indicatief voor de aanwezigheid van meer persoonlijkheidskenmerken die passen bij een persoonlijkheidsstoornis. | |
| Intake | Copingstijl | Utrecht Coping List (UCL) (Schreurs e.a., 1993) | De UCL stelt het karakteristieke copinggedrag vast en bestaat uit 47 items en omvat zeven subschalen: Actief aanpakken, Palliatieve reactie, Vermijden, Sociale steun zoeken, Passief reactiepatroon, Expressie van emoties en Geruststellende gedachten. Items worden gescoord op een 4-punt Likertschaal van 1 (zelden of nooit) tot 4 (zeer vaak). Hogere scores zijn indicatief voor het vaker hanteren van een specifieke copingstijl. | |
| T0, T1, T2, T3 | Symptoomlast | Sideline Concussion Assessment Tool 5 (SCAT5) (Echemendia e.a., 2017) | De SCAT5 bestaat uit 22 symptomen en deelnemers scoren de ernst van deze symptomen op een 7-punt Likertschaal, variërend van 0 (geen) tot 6 (ernstig). Alle items worden opgeteld om tot een totaalscore te komen. Hogere scores zijn indicatief voor een zwaardere symptoomlast. | |
| T0, T2, T3 | Functionele uitkomst | Glasgow Outcome Scale – extended (GOS-E; Wilson e.a., 2009) | De GOS-E bestaat uit acht items en evalueert de functionele uitkomst van patiënten na traumatisch hersenletsel. De totaalscore weerspiegelt het niveau van functioneren, waarbij hogere scores indicatief zijn voor een beter functioneren. | |
| T0, T2, T3 | Participatie | Utrecht Scale for Evaluation of Rehabilitation (USER-P; Post e.a., 2012) | De USER-P meet participatie en bestaat uit 31 items en omvat drie subschalen: Frequentie, Tevredenheid en Beperkingen van participatie in het dagelijks leven. Hogere scores zijn indicatief voor een betere participatie. | |
| T0, T2, T3 | Angst en depressie | Hospital Anxiety and Depression Scale (HADS) (Zigmond & Snaith, 1983) | De HADS bestaat uit veertien items die worden beoordeeld op een 4-punts Likertschaal, variërend van 0 (afwezigheid) tot 3 (zeer aanwezig). Totaalscores werden berekend door de scores op de angst- (HADS-A) en depressie-items (HADS-D) respectievelijk bij elkaar op te tellen. Hogere scores zijn indicatief voor een zwaardere symptoomlast. | |
| T0, T2, T3 | Slaapproblemen | The Pittsburg Sleep Quality Index (PSQI; Buysse e.a., 1989) | De PSQI bestaat uit negentien items en omvat zeven subschalen die verschillende aspecten van slaapkwaliteit beoordelen. De totaalscore werd berekend door de scores op de subschalen bij elkaar op te tellen. Hogere scores zijn indicatief voor ernstiger slaapproblemen. | |
| T0, T2, T3 | Vermoeidheid | Checklist Individuele Spankracht (CIS; Vercoulen e.a., 1999) | De CIS meet subjectieve vermoeidheid en gedragsaspecten die hieraan gerelateerd zijn. De CIS bestaat uit twintig uitspraken waar deelnemers op een 7-punts Likertschaal aangeven in hoeverre de uitspraak op hen van toepassing is, variërend van 1 (mee oneens) tot 7 (mee eens). Hogere scores zijn indicatief voor een sterkere mate van vermoeidheid. | |
| Multidisciplinaire meting | T0, T2, T3 | Neurocognitief functioneren | Computergestuurde tests (Königs e.a., 2021) | Zie beschrijving in Box 1, p. 130. |
| T0, T2, T3 | Statische en dynamische balans | Motek DynSTABLE * | De DynSTABLE bestaat uit een krachtplatform waarmee metingen worden gedaan van statische stabiliteit (het vermogen om stabiele staande balans te behouden in een double-leg stance met ogen open) en de visuele afhankelijkheid tijdens de statische stabiliteit (het verschil in statische balans met ogen dicht vs. ogen open) en dynamische stabiliteit (tijd tot stabilisatie na een gestandaardiseerde pertubatie door het klachtplatform). Lagere scores zijn indicatief voor betere balans. | |
| T0, T2, T3 | Vestibulair-oculair functioneren | Vestibular/OculoMotor Screening (VOMS) (Mucha e.a., 2014) | De VOMS wordt gebruikt om de integratie van balans, zicht en beweging in kaart te brengen. De VOMS screent vestibulaire en visuele symptomen die ontstaan door verschillende soorten provocaties in zeven tests, waaronder smooth pursuit, saccades (horizontaal en verticaal), vestibulo-oculaire reflex (horizontaal en verticaal) en gevoeligheid voor visuele beweging. Deelnemers moesten de ernst van vier verschillende symptomen (hoofdpijn, duizeligheid, misselijkheid en 'niet helder kunnen nadenken') beoordelen op een schaal van 0 (geen) tot 10 (ernstig) voorafgaand aan de tests en na elke test. De maximale contrastscore betreft het maximale verschil tussen de baseline-symptomen en de symptomen na een item. Hogere scores zijn indicatief voor een sterkere procovatie van klachten. De VOMS meet ook het proximale convergentiepunt, oftewel de minimale afstand van een voorwerp tot de ogen waarop men net niet dubbelziet. |
Noot. *Alleen voor deelnemers die in staat waren om naar het Sportmedisch Centrum van de KNVB te komen
Resultaten
Populatie
In deze studie werden 64 deelnemers (75% vrouw) geïncludeerd met een gemiddelde leeftijd van 39,3 jaar (SD = 12,2) en een relatief hoog opleidingsniveau (gemiddelde = 6,4, vergelijkbaar met hoger onderwijs). Vanwege een tegenvallende inclusiesnelheid werden twee deelnemers geïncludeerd die minder dan twaalf maanden na het letsel startten met hun behandeling (10,9 en 11,3 maanden). Demografische en medische gegevens, kenmerken van de hersenschudding en persoonskenmerken van 64 deelnemers zijn weergegeven in Tabel 2 (p. 119). Op het gebied van persoonlijkheidskenmerken zijn de scores voor zelfcontrole, identiteitsintegratie, verantwoordelijkheid, relationele capaciteiten en sociale concordantie op een gemiddeld niveau ten opzichte van beschikbare normscores (49,9 < T-scores > 53,2). Na de eerste meting (voor de behandeling) vielen drie deelnemers uit bij de vervolgmetingen (na de behandeling, redenen: long-COVID: n = 1; te hoge belasting: n = 1; reden onbekend: n = 1), waarvan de ontbrekende gegevens werden geïmputeerd. Vanwege het aflopen van de looptijd van de studie konden niet alle langetermijnmetingen worden uitgevoerd, en zijn in totaal T3-metingen beschikbaar voor 52 deelnemers. Een totaal van 26 personen werd uitgesloten van deelname vanwege de aanwezigheid van een neurologische aandoening anders dan een hersenschudding.
Tabel 2 Demografische en persoonlijke kenmerken
| N (% van 64) | Gemiddelde (SD) | ||
|---|---|---|---|
| Demografische gegevens | Sekse (man) | 16 (25) | |
| Leeftijd | 39,3 (12,2) | ||
| Opleidingsniveau | 6,4 (0,8) | ||
| Medische gegevens | Leerstoornis | 5 (7,8) | |
| Dyslexie | 5 (7,8) | ||
| Psychiatrische stoornis | 11 (17,2) | ||
| ADHD | 5 (7,8) | ||
| Depressie | 2 (3,1) | ||
| Angststoornis | 3 (4,7) | ||
| Persoonlijkheidsstoornis | 1 (1,6) | ||
| PTSS | 3 (4,7) | ||
| Kenmerken hersenschudding | Eerdere hersenschudding | 22 (34,4) | |
| Bewustzijnsverlies | 29 (45,3) | ||
| Anterograde PTA | 20 (31,3) | ||
| Overgeven | 9 (14,1) | ||
| Maanden sinds letsel | 57,1 (47,7) | ||
| Persoonskenmerken | Verwachtingen (0-100) | 69,9 (17,2) | |
| Persoonlijkheidsstructuur (SIPP-SF), ruwe score | |||
| Zelfcontrole | 40,4 (6,1) | ||
| Sociale concordantie | 40,7 (5,5) | ||
| Identiteitsintegratie | 39,2 (6,8) | ||
| Relationele capaciteiten | 40,8 (5,8) | ||
| Verantwoordelijkheid | 42,75 (4,4) | ||
| Copingstijl (UCL), ruwe score | |||
| Actief aanpakken | 13,3 (3,4) | ||
| Palliatieve reactie | 11,5 (3,0) | ||
| Vermijden | 8,3 (3,5) | ||
| Sociale steun zoeken | 8,9 (3,7) | ||
| Passief reactiepatroon | 6,5 (3,4) | ||
| Emoties uiten | 2,8 (1,5) | ||
| Geruststellende gedachten | 8,6 (2,6) |
Noot. SD = standaarddeviatie, PTA = posttraumatische amnesie, SIPP-SF = Severity Indices of Personality Problems – Short Form, UCL = Utrechtse CopingLijst
Verandering door de tijd
De resultaten van metingen van het functioneren van deelnemers voor de behandeling, een maand na de behandeling en zes maanden na de behandeling zijn weergegeven in Tabel 3 (p. 121 e.v.).
Kortetermijnverandering in functioneren
De symptoomlast (SCAT5) van deelnemers was een maand na de behandeling significant lager dan voor de behandeling (zie Figuur 2, p. 120). Daarbij was ook sprake van afnames in de zelfrapportage van angst (HADS-A), depressie (HADS-D), vermoeidheid (CIS) en slaapproblemen (PSQI). Ook werden verbeteringen geobserveerd in het vestibulair-oculair functioneren (VOMS) en alle gemeten domeinen van het neurocognitief functioneren (Emma Toolbox). Tot slot lieten deelnemers verbetering zien in het algemeen functioneren (GOS-E), hun tevredenheid over participatie (USER-P) en de ervaren restricties in de dagelijkse participatie (USER-P). De resultaten bieden geen evidentie voor statistisch significante verandering in balans (DynSTABLE) of mate van participatie (USER-P).
Langetermijnverandering in functioneren
Alle beschreven kortetermijnveranderingen werden ook geobserveerd op de langere termijn, zes maanden na de behandeling. Daarnaast lieten deelnemers een verbetering zien in de mate van participatie (USER-P). In de periode van een maand na de behandeling tot zes maanden na de behandeling werden geen veranderingen in het functioneren waargenomen, met uitzondering van verbeteringen in klachten van depressie (HADS-D) en vermoeidheid (CIS), neurocognitieve prestaties op het gebied van informatieverwerking en aandachtscontrole, het verbaal geheugen en de tevredenheid over participatie (USER-P).
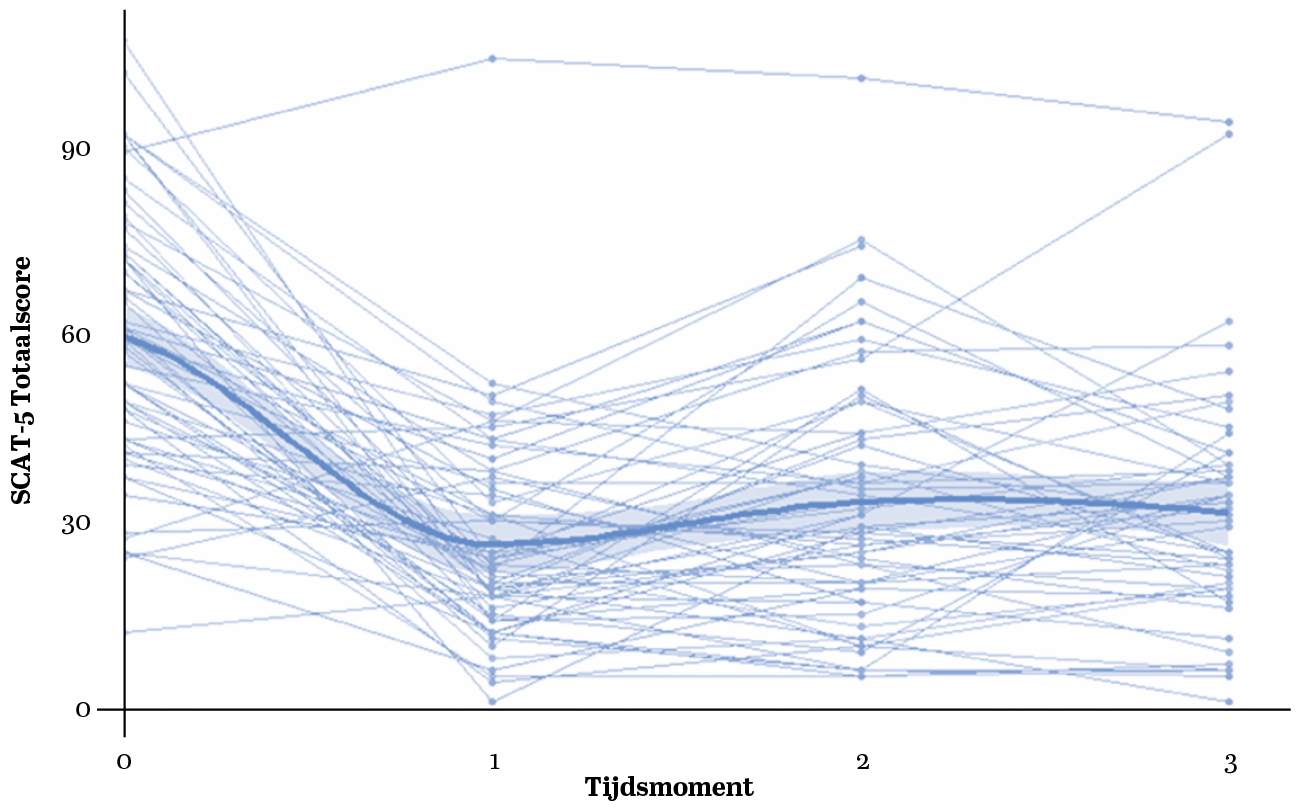
Figuur 2 Veranderingen in symptoomlast (SCAT5) over tijd
Noot. De gekleurde lijnen vertegenwoordigen individuele deelnemers (n = 64), waarbij elke kleur een andere deelnemer weergeeft. De dikgedrukte blauwe lijn geeft het gemiddelde van alle deelnemers weer, met het bijbehorende 95%-betrouwbaarheidsinterval. Tijdsmoment 0 (T0) staat voor de metingen vóór de behandeling, T1 een week na de behandeling, T2 een maand na de behandeling en T3 betreft de metingen zes maanden na de behandeling.
Tabel 3 Korte- en langetermijnverandering in functioneren
| T0 (n = 64) | T2 (n = 64) | T0 (n = 52) | T3 (n = 52) | T2 (n = 52) | T3 (n = 52) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Uitkomst | Gemiddelde (SD) | t-test | EG | Gemiddelde (SD) | t-test | EG | Gemiddelde (SD) | t-test | EG | |||
| Symptoomlast | ||||||||||||
| SCAT5 | 59,5 (20,9) | 32,9 (20,8) | 7,8*** | 0,99 | 59,4 (21,0) | 31,2 (19,0) | 8,0*** | 1,11 | 32,1 (20,5) | 31,2 (19,0) | 0,4 | 0,05 |
| Psychologisch functioneren | ||||||||||||
| Angst (HADS) | 7,9 (3,7) | 6,4 (4,4) | 2,8* | 0,35 | 7,8 (3,7) | 5,8 (3,7) | 3,4** | 0,47 | 6,3 (4,4) | 5,8 (3,7) | 1,0 | 0,13 |
| Depressie (HADS) | 8,0 (4,1) | 6,0 (4,3) | 3,9*** | 0,48 | 7,9 (4,5) | 4,9 (3,7) | 5,3*** | 0,74 | 5,9 (4,5) | 4,9 (3,7) | 2,1* | 0,29 |
| Vermoeidheid (CIS) | 94,0 (15,0) | 72,2 (21,0) | 7,5*** | 0,93 | 94,3 (15,5) | 66,9 (18,6) | 8,8*** | 1,23 | 72,6 (21,7) | 66,9 (18,6) | 2,2* | 0,31 |
| Slaapproblemen (PSQI) | 7,8 (3,0) | 6,2 (3,0) | 4,4*** | 0,55 | 7,5 (3,0) | 5,8 (2,7) | 4,0*** | 0,55 | 6,1 (3,0) | 5,8 (2,7) | 0,8 | 0,11 |
| Prestatietests | ||||||||||||
| Vestibulo-oculomotorische screening (VOMS) | ||||||||||||
| Proximale convergentiepunt | 5,1 (7,6) | 2,0 (3,4) | 3,8** | 0,47 | 4,9 (7,0) | 2,2 (4,3) | 3,8** | 0,53 | 2,1 (3,6) | 2,2 (4,3) | -0,2 | -0,03 |
| Vestibulair-oculair functioneren | 1,2 (1,2) | 0,5 (0,8) | 5,3*** | 0,66 | 1,2 (1,2) | 0,7 (1,1) | 3,4** | 0,47 | 0,5 (0,8) | 0,7 (1,1) | -1,1 | -0,16 |
| Neurocognitieve functies (Emma Toolbox, z-score) | ||||||||||||
| Informatieverwerking & Aandachtscontrole | -1,7 (2,1) | -0,2 (1,3) | -8,1*** | 1,01 | -1.6 (2,0) | 0,1 (1,3) | -8,0*** | 1,10 | -0,1 (1,4) | 0,1 (1,3) | -2,7* | 0,37 |
| Verbaal geheugen | 0,3 (1,1) | 1,1 (0,8) | -7,7*** | 0,96 | 0,3 (1,1) | 1,7 (0,6) | -9,1*** | 1,27 | 1,2 (0,8) | 1,7 (0,6) | -6,1*** | 0,85 |
| Visueel geheugen | -0,1 (1,1) | 0,6 (0,5) | -5,0*** | 0,63 | 0,0 (1,0) | 0,7 (0,4) | -5,5*** | 0,76 | 0,6 (0,4) | 0,7 (0,4) | -1,7 | 0,23 |
| Verbaal werkgeheugen | 0,0 (1,0) | 0,6 (1,2) | -4,8*** | 0,60 | 0,0 (1,0) | 0,7 (1,2) | -5,9*** | 0,82 | 0,6 (1,2) | 0,7 (1,2) | -0,8 | 0,11 |
| Visueel werkgeheugen | -0,1 (1,0) | 0,1 (0,9) | -3,0** | 0,38 | 0,0 (1,0) | 0,3 (1,0) | -3,2** | 0,45 | 0,2 (0,9) | 0,3 (1,0) | -1,0 | 0,14 |
| Visuomotorische integratie | -0,9 (1,9) | -0,2 (1,0) | -3,3** | 0,41 | -0,8 (1,8) | -0,1 (1,1) | -4,4*** | 0,60 | -0,2 (1,0) | -0,1 (1,1) | -1,0 | 0,14 |
| Algemeen functioneren | ||||||||||||
| Functionele uitkomst (GOS-E) | 5,1 (0,8) | 5,5 (0,8) | -4,6*** | 0,58 | 5,0 (0,7) | 5,4 (0,8) | -2,9** | 0,40 | 5,5 (0,8) | 5,4 (0,8) | 0,7 | -0,10 |
| Participatie, frequentie (USER-P) | 30,0 (8,3) | 30,2 (8,3) | -0,1 | 0,02 | 29,8 (8,4) | 32,6 (8,5) | -2,8* | 0,39 | 30,3 (8,1) | 32,6 (8,5) | -2,0 | 0,27 |
| Participatie, restricties (USER-P) | 61,9 (12,0) | 70,4 (15,1) | -5,1*** | 0,63 | 61,2 (11,3) | 73,2 (13,4) | -6,1*** | 0,85 | 70,8 (14,8) | 73,2 (13,4) | -1,4 | 0,19 |
| Participatie, tevredenheid (USER-P) | 40,3 (15,9) | 51,4 (18,5) | -4,7*** | 0,58 | 39,9 (15,9) | 57,0 (17,3) | -6,9*** | 0,95 | 50,8 (18,7) | 57,0 (17,3) | -3,2** | 0,44 |
| Balans (DynSTABLE) | T0 (n = 36) | T2 (n = 36) | T0 (n = 32) | T3 (n = 32) | T2 (n = 32) | T3 (n = 32) | ||||||
| Statische balans (cm/s) | 5,0 (3,1) | 4,2 (2,4) | 1,9 | 0,31 | 5,2 (3,2) | 4,0 (0,7) | 2,1 | 0,37 | 4,3 (2,6) | 4,0 (0,7) | 0,7 | 0,13 |
| Visuele afhankelijkheid (verschil in cm/s) | 1,4 (0,5) | 1,4 (0,4) | 0,3 | 0,05 | 1,4 (0,5) | 1,3 (0,3) | 1,5 | 0,27 | 1,4 (0,4) | 1,3 (0,3) | 1,2 | 0,21 |
| Dynamische balans (s tot stabilisatie) | 2,8 (1,4) | 2,6 (0,8) | 0,7 | 0,12 | 2,9 (1,4) | 2,5 (1,0) | 1,6 | 0,29 | 2,7 (0,8) | 2,5 (1,0) | 1,1 | 0,19 |
Noot. Positieve effectgrootten (EG, Cohen's d) indiceren voortuitgang. SD = standaarddeviatie; HADS = Hospital Anxiety and Depression Scale; CIS = Checklist Indiviuele Spankracht; PSQI = Pittsburg Sleep Quality Index; VOMS = Vestibulo-oculoMotor Screening; GOS-E – Glasgow Outcome Scale – Extended; USER-P: Utrecht Scale for Evaluation of Rehabilitation;, s = seconden.
* p < ,05; ** p < ,01, *** p < ,001
Betekenisvolle verandering
De aanwezigheid van betekenisvolle verandering op individueel niveau is weergegeven in Tabel 4 (p. 123 e.v.). Op het gebied van symptoomlast rapporteerde 69% van de deelnemers een betekenisvolle verbetering een maand na de behandeling (SCAT5) en 77% zes maanden na de behandeling. Op andere uitkomstmaten liet tussen de 22% (statische balans, DynSTABLE) en 72% (Informatieverwerking & Aandachtscontrole en Verbaal geheugen, Emma Toolbox) van de deelnemers een maand na de behandeling een betekenisvolle verbetering zien en tussen de 29% (slaapproblemen, PSQI) en 85% (vermoeidheid, CIS) zes maanden na de behandeling.
Niet alle deelnemers gingen vooruit; 9% van de deelnemers rapporteerde een betekenisvolle achteruitgang op het gebied van symptoomlast een maand na de behandeling en 6% van de deelnemers rapporteerde een betekenisvolle achteruitgang zes maanden na de behandeling. Op andere uitkomstmaten liet tussen de 2% (functionele uitkomst, GOS-E) en 42% (visuele afhankelijkheid van de balans, DynSTABLE) van de deelnemers een maand na de behandeling een betekenisvolle achteruitgang zien en tussen de 2% (Informatieverwerking & Aandachtscontrole, Emma Toolbox) en 28% (visuele afhankelijkheid van de balans, DynSTABLE) zes maanden na de behandeling.
Tabel 4 Betekenisvolle verandering
| T0-T2 (n = 64) | T0-T3 (n = 52) | T2-T3 (n = 52) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Uitkomst | beter | gelijk | slechter | χ2 | beter | gelijk | slechter | χ2 | beter | gelijk | slechter | χ2 |
| Symptoomlast | ||||||||||||
| SCAT5 | 44 (69%) | 14 (22%) | 6 (9%) | 1152,4*** | 40 (77%) | 9 (17%) | 3 (6%) | 1181,6*** | 17 (33%) | 21 (40%) | 14 (27%) | 194,5*** |
| Psychologisch functioneren | ||||||||||||
| Angst (HADS) | 17 (33%) | 20 (38%) | 15 (29%) | 592,4*** | 31 (60%) | 7 (13%) | 14 (27%) | 695,9*** | 17 (33%) | 20 (38%) | 15 (29%) | 194,5*** |
| Depressie (HADS) | 17 (33%) | 24 (46%) | 11 (21%) | 632,0*** | 31 (60%) | 17 (33%) | 4 (8%) | 695,9*** | 17 (33%) | 24 (46%) | 11 (21%) | 194,5*** |
| Vermoeidheid (CIS) | 24 (46%) | 16 (31%) | 12 (23%) | 1321,3*** | 44 (85%) | 4 (8%) | 4 (8%) | 1438,5*** | 24 (46%) | 16 (31%) | 12 (23%) | 406,5*** |
| Slaapproblemen (PSQI) | 15 (29%) | 26 (50%) | 11 (21%) | 592,4*** | 15 (29%) | 26 (50%) | 11 (21%) | 148,1*** | 15 (29%) | 26 (50%) | 11 (21%) | 148,1*** |
| Prestatietests | ||||||||||||
| Vestibulo-oculomotorische screening (VOMS) | ||||||||||||
| Proximale convergentiepunt | 23 (36%) | 35 (55%) | 6 (9%) | 293,6*** | 17 (33%) | 32 (62%) | 3 (6%) | 194,5*** | 5 (10%) | 39 (75%) | 8 (15%) | 10,8*** |
| Vestibulair-oculair functioneren | 33 (52%) | 28 (44%) | 3 (5%) | 632,0*** | 23 (44%) | 18 (35%) | 11 (21%) | 371,5*** | 7 (13%) | 35 (67%) | 10 (19%) | 25,6*** |
| Neurocognitieve functies (Emma Toolbox) | ||||||||||||
| Informatieverwerking & Aandachtscontrole | 46 (72%) | 17 (27%) | 1 (2%) | 1263,7*** | 40 (77%) | 11 (21%) | 1 (2%) | 1181,6*** | 10 (19%) | 37 (71%) | 5 (10%) | 59,7*** |
| Verbaal geheugen | 46 (72%) | 13 (20%) | 5 (8%) | 1263,7*** | 42 (81%) | 8 (15%) | 2 (4%) | 1306,9*** | 36 (69%) | 13 (25%) | 3 (6%) | 950,0*** |
| Visueel geheugen | 35 (55%) | 18 (28%) | 11 (17%) | 715,1*** | 33 (63%) | 18 (35%) | 1 (2%) | 792,8*** | 22 (42%) | 17 (33%) | 13 (25%) | 338,1*** |
| Verbaal werkgeheugen | 39 (61%) | 14 (22%) | 11 (17%) | 896,6*** | 34 (67%) | 14 (27%) | 3 (6%) | 843,6*** | 20 (38%) | 20 (38%) | 12 (23%) | 275,9*** |
| Visueel werkgeheugen | 28 (44%) | 25 (39%) | 11 (17%) | 446,8*** | 25 (48%) | 21 (40%) | 6 (12%) | 443,1*** | 19 (37%) | 19 (37%) | 14 (27%) | 247,2*** |
| Visuomotorische integratie | 26 (41%) | 32 (50%) | 6 (9%) | 381,6*** | 26 (50%) | 23 (44%) | 3 (6%) | 481,3*** | 16 (31%) | 25 (48%) | 11 (21%) | 170,5*** |
| Algemeen functioneren | ||||||||||||
| Functionele uitkomst (GOS-E) | 21 (33%) | 42 (66%) | 1 (2%) | 241,3*** | 17 (33%) | 32 (62%) | 3 (6%) | 194,5*** | 10 (19%) | 32 (62%) | 10 (19%) | 59,7*** |
| Participatie, frequentie (USER-P) | 22 (34%) | 18 (28%) | 24 (38%) | 266,8*** | 27 (52%) | 15 (29%) | 10 (19%) | 521,1*** | 28 (54%) | 11 (21%) | 13 (25%) | 562,4*** |
| Participatie, restricties (USER-P) | 37 (58%) | 18 (28%) | 9 (14%) | 803,3*** | 36 (69%) | 12 (23%) | 4 (8%) | 950,0*** | 22 (42%) | 22 (42%) | 8 (15%) | 338,1*** |
| Participatie, tevredenheid (USER-P) | 36 (56%) | 21 (33%) | 7 (11%) | 758,6*** | 37 (71%) | 11 (21%) | 4 (8%) | 1005,5*** | 22 (42%) | 22 (42%) | 8 (15%) | 338,1*** |
| Balans (DynSTABLE) | T0-T2 (n =36) | T2-T3 (n=32) | T2-T3 (n=32) | |||||||||
| Statische balans (cm/s) | 8 (22%) | 25 (69%) | 3 (8%) | 57,4*** | 15 (47%) | 14 (44%) | 3 (9%) | 258,5*** | 6 (19%) | 21 (66%) | 5 (16%) | 34,7*** |
| Visuele afhankelijkheid (Verschil in cm/s) | 11 (31%) | 10 (28%) | 15 (42%) | 116,3*** | 11 (34%) | 12 (38%) | 9 (28%) | 133,4*** | 11 (34%) | 14 (44%) | 7 (22%) | 133,4*** |
| Dynamische balans (s tot stabilsatie) | 11 (31%) | 15 (42%) | 10 (28%) | 116,3*** | 15 (47%) | 11 (34%) | 6 (19%) | 258,5*** | 15 (47%) | 10 (31%) | 7 (22%) | 258,5*** |
Noot. HADS = Hospital Anxiety and Depression Scale; CIS = Checklist Indiviuele Spankracht; PSQI = Pittsburg Sleep Quality Index; VOMS = Vestibulo-oculoMotor Screening; GOS-E – Glasgow Outcome Scale – Extended; USER-P: Utrecht Scale for Evaluation of Rehabilitation; s = seconden.
* p < ,05; ** p < ,01, *** p < ,001
Predictoren van verandering in symptoomlast
Een multiple regressiemodel waarin predictoren beschikbaar waren voor het verklaren van de mate van verandering in symptoomlast één maand na de behandeling, laat zien dat deze ten dele wordt verklaard (R² = 23,3%) door persoonskenmerken en het functioneren voorafgaand aan de behandeling (Tabel 5. p. 127). Een hogere zelfrapportage van vermoeidheid (CIS) en een minder sterk verantwoordelijkheidsgevoel (SIPP-SF) waren gerelateerd aan een grotere afname in symptomen na de behandeling.
Tabel 5 Predictoren van verandering in symptoomlast na de behandeling
| Model | Predictoren | Statistiek | Prestatie | Fit | ||
|---|---|---|---|---|---|---|
| B (SE) | p | R2 | 95%-BI | AIC | ||
| Demografische en medische achtergrond | Sekse (vrouw) | -0,18 (0,12) | 0,148 | 3,3% | 0,4-20,4 | 184,4 |
| Kenmerken hersenschudding | Bewustzijnsverlies | -0,29 (0,12) | 0,023 | 9,6% | 0,4-23,7 | 182,1 |
| Overgeven | 0,17 (0,12) | 0,162 | ||||
| Persoonskenmerken | Verantwoordelijkheid (SIPP-SF) | 0,24 (0,12) | 0,054 | 10,2% | 0,7-26,5 | 181,7 |
| Verwachtingen | -0,19 (0,12) | 0,115 | ||||
| Functioneren bij aanvang | Vermoeidheid (CIS) | -0,32 (0,12) | 0,010 | 10,3% | 0,4-30,8 | 179,7 |
| Alle predictorsets | Sekse (vrouw) | -0,20 (0,12) | 0,105 | 23,3% | 9,0-40,6 | 138,97 |
| Verantwoordelijkheid (SIPP-SF) | 0,29 (0,12) | 0,018 | ||||
| Vermoeidheid (CIS) | -0,27 (0,12) | 0,022 | ||||
| Anterograde PTA | -0,17 (0,12) | 0,141 | ||||
Noot. Voor de uitkomstmaat geldt dat lagere waarden indicatief zijn voor een sterkere afname van de symptoomlast. N = 64. SE = standaarderror; BI = betrouwbaarheidsinterval; AIC = Aikaike's Information Criterion; CIS = Checklist Individuele Spankracht; SIPP-SF = Severity Indices of Personality Problems – Short Form; PTA = posttraumatische amnesie.
Discussie
Deze studie vormt het eerste onafhankelijk prospectieve onderzoek naar de CFX-behandeling. De resultaten laten zien dat deelnemers gemiddeld een lagere symptoomlast rapporteren, waarbij zes maanden na de behandeling voor 77% van de patiënten een betekenisvolle afname van de symptoomlast werd geobserveerd. Positieve veranderingen werden ook geobserveerd op vragenlijsten voor angstige en depressieve gevoelens, vermoeidheid en slaap. Niet alle deelnemers gingen vooruit; 9% van de deelnemers had een hogere symptoomlast na de behandeling. Betekenisvolle achteruitgang op een maand na de behandeling werd het meest geobserveerd op metingen voor balans (42%), participatie (38%) en gevoelens van angst (29%), vermoeidheid (23%) en depressie (21%).
Dit onderzoek laat zien dat er gemiddeld gezien sprake is van een subjectieve verbetering bij mensen die de CFX-behandeling ondergaan, en dat deze observatie ook standhoudt op de langere termijn (zes maanden na de behandeling). Veranderingen in het functioneren werden daarnaast geobserveerd op functietests voor het vestibulair-oculair functioneren en neurocognitief functioneren, op zowel de korte termijn als de langere termijn. Deze resultaten wijzen erop dat de behandeling bij CFX eveneens gepaard gaat met betere prestaties op functietests. Daarbij moet vermeld worden dat dit ook secundair kan zijn aan verbeteringen in het psychologisch functioneren (Semkovska e.a., 2019) en het is onbekend in hoeverre oefeneffecten een rol hebben gespeeld, al is de mogelijke invloed daarvan beperkt door het gebruik van parallelversies waar mogelijk (zoals bij de geheugentests). Tot slot rapporteerden deelnemers op de langere termijn een verbetering in de mate van participatie in het dagelijks leven. Deze bevindingen zijn waargenomen in een onderzoeksgroep van gemiddeld 39 jaar oud, voor de meerderheid bestaande uit vrouwen (75%) met een opleidingsniveau dat overeenkomstig is met hoger onderwijs. Het blijft onduidelijk in hoeverre de bevindingen uit het onderzoek generaliseerbaar zijn naar de bredere populatie van mensen met langdurige klachten, zoals jongeren, mannen of mensen met een lager opleidingsniveau.
Vanwege het ontbreken van een controlegroep en een gerandomiseerd onderzoeksdesign, biedt de geobserveerde vooruitgang van deelnemers geen directe evidentie voor effectiviteit van de CFX-behandeling. Voor de waargenomen veranderingen kan niet worden bepaald in hoeverre deze tot stand zijn gekomen door non-specifieke (onbedoelde) behandeleffecten, zoals een placebo-effect. Diverse eigenschappen van een behandeling kunnen een onbedoelde rol spelen bij het verbeteren van het welzijn van patiënten, met name bij chronische aandoeningen (Ongaro & Kaptchuk, 2019). Zo kunnen behandelingen die aan patiënten worden voorgesteld als kostbaar daardoor mogelijk effectiever zijn (Espay e.a., 2015). Bovendien kunnen de effecten van een placebo gedurende een langere periode aanhouden, tot langer dan een jaar (Wartolowska e.a., 2017). Het is dus belangrijk om inzicht te verkrijgen in de mechanismen die onderliggend kunnen zijn aan de waargenomen veranderingen in het functioneren. Daarom is de samenhang tussen deelnemerskarakteristieken en symptoomlast na de behandeling onderzocht. Daarbij viel met name op dat de meerderheid van de waargenomen verschillen in symptoomlast (76%) na de behandeling niet kon worden verklaard aan de hand van karakteristieken van de deelnemers gerelateerd aan demografische en medische achtergrond, kenmerken van de hersenschudding (onder andere maanden sinds letsel), persoonskenmerken en het functioneren bij aanvang. De resultaten van het huidige onderzoek laten wel aanwijzingen zien voor een bescheiden bijdrage van psychologische factoren. Mensen met bepaalde psychologische kenmerken voor aanvang van de behandeling (hogere mate van vermoeidheid en/of een minder sterk verantwoordelijkheidsgevoel) lieten een sterkere afname in symptoomlast zien.
Aangezien het grootste deel van de verschillen in symptoomlast na de CFX-behandeling niet statistisch verklaard kon worden, kan alleen gespeculeerd worden over andere mechanismen die verklarend kunnen zijn voor de onderzoeksresultaten. Claimt CFX dat het herstel van verstoringen in de lokale zuurstofafgifte aan actieve hersengebieden de basis vormt voor de verbeteringen die patiënten ervaren na de behandeling, deze hypothese kon in dit onderzoek niet getoetst worden. Ook andere biologische mechanismen kunnen niet worden uitgesloten als mogelijke verklaring voor de veranderingen die in dit onderzoek geobserveerd zijn, zoals eventuele effecten van cardiovasculaire training. Cardiovasculaire training vormt een centraal onderdeel van de behandeling van CFX, en hiervan zijn reeds positieve effecten bekend op het herstel van klachten bij mensen in de acute fase van een hersenschudding (Leddy e.a., 2023). Cognitieve functietraining heeft een centrale plek in de CFX-behandeling, maar op basis van negatieve bevindingen in de bestaande literatuur lijkt het onwaarschijnlijk dat de waargenomen verschillen verklaard kunnen worden door positieve effecten van cognitieve functietraining (Katz e.a., 2017). Ook eventuele effecten van vestibulair-oculaire training kan niet worden uitgesloten, al is er slechts zeer beperkt bewijs voor een positieve invloed op het dagelijks leven (Kaldenberg e.a., 2022). Ook psychologische mechanismen kunnen een rol spelen, zoals de verlichting van angst voor het uitvoeren van activiteiten (fear avoidance) door blootstelling aan een intensief en actief behandelprogramma (Wijenberg e.a., 2017). Samenvattend is het mogelijk dat bevindingen van dit onderzoek kunnen worden verklaard door placebo-effecten, biologische of psychologische mechanismen, of een combinatie daarvan.
Op basis van de bevindingen in dit onderzoek, onderschrijven we het belang van toekomstig hypothesegedreven onderzoek naar het toetsen van behandelonderdelen die bij kunnen dragen aan de waargenomen verbeteringen in het functioneren, zoals cardiovasculaire training en exposuretherapie. In de zoektocht naar effectieve interventies vragen we aandacht voor de meest recente wetenschappelijke inzichten ten aanzien van de onderliggende oorzaken van aanhoudende klachten. De wetenschappelijke literatuur laat aanwijzingen zien voor de relevantie van zowel neurologische oorzaken, zoals afwijkingen in de wittestofintegriteit of functionele connectiviteit na een hersenschudding die voorspellend zijn voor aanhoudende klachten (Bai e.a., 2020; Woodrow e.a., 2023), als psychologische oorzaken, zoals een verhoogd risico op aanhoudende klachten voor mensen met een premorbide psychiatrische diagnose (Van der Naalt e.a., 2017) of een niet-adaptieve psychologische respons op aanhoudende klachten (Cassetta e.a., 2021). Belangrijker is dat neurologische en psychologische oorzaken van aanhoudende klachten niet goed op individueel niveau te onderscheiden zijn en elkaar bovendien kunnen beïnvloeden (Clark e.a., 2022). De stand van de literatuur vraagt dus om erkenning van de complexiteit van aanhoudende klachten. Het is daarmee waarschijnlijk dat aanhoudende klachten tot stand komen door een combinatie van onderliggende mechanismen, waarvan de configuratie niet voor iedereen hetzelfde is. De hypothese die hieruit voortvloeit is dat de meest effectieve behandeling ook niet voor iedereen hetzelfde zal zijn.
Conclusie
De resultaten van dit onderzoek vormen een onafhankelijke informatiebron voor behandelaars en mensen met langdurige klachten na een hersenschudding. De CFX-behandeling gaat bij de meerderheid van de onderzochte mensen gepaard met verbeteringen in het functioneren, die standhouden op de langere termijn. De behandeling kan bij een minderheid ook gepaard gaan met een achteruitgang in het functioneren. Als gevolg van het ontbreken van een controlegroep en gerandomiseerd onderzoeksdesign, vormen de resultaten geen direct bewijs voor de effectiviteit van de CFX-behandeling. Hypothesegedreven onderzoek naar effectieve behandelcomponenten is nodig voor de ontwikkeling van gerichte interventies voor aanhoudende klachten na een hersenschudding.
Bijlage
Box 1 Neurocognitieve tests
Het neurocognitief functioneren is gemeten met een samengestelde batterij van computergestuurde neurocognitieve tests (Emma Toolbox, beschreven in Königs e.a., 2021). De testbatterij is gericht op het in kaart brengen van neurocognitieve functies op het gebied van informatieverwerking, aandacht, geheugen, werkgeheugen en visuomotoriek. De gebruikte tests en de daaruit voortvloeiende variabelen staan beschreven in onderstaande tabel. Om het aantal uitkomstmaten te reduceren, zijn neurocognitieve domeinscores geconstrueerd aan de hand van principale componentanalyse, zoals beschreven in Königs e.a., 2021. In onderstaande tabel staat weergegeven uit welke variabelen de neurocognitieve domeinen zijn opgebouwd. Alleen de scores op het niveau van neurocognitieve domeinen zijn gebruikt in dit onderzoek. De scores zijn gecorrigeerd voor leeftijd aan de hand van regressieanalyse in een groep van 101 gezonde volwassenen met een gemiddelde leeftijd van 18 tot 64 jaar (M = 32,3 jaar), waarvan 46% man, met een gemiddeld opleidingsniveau van 6,4 (range: 5-8). Alle scores zijn weergegeven in leeftijdsgecorrigeerde z-scores ten opzichte van de controlegroep, waarbij hogere waarden een betere neurocognitieve prestatie reflecteren.
| Domeinen & Variabelen | Beschrijving | Definitie | Taak | Beschrijving |
|---|---|---|---|---|
| Informatieverwerking en Aandachtscontrole | ||||
| Stabilitieit van informatieverwerking | De variabiliteit van reageren op het verschijnen van een doelwit. | Standaarddeviatie van de reactietijd (ms) op trials met neutrale doelwitten. | Attention Network Test (Fan e.a., 2002) | Doelwitten die naar rechts of links wijzen worden gepresenteerd op een computerscherm. Deelnemers worden geïnstrueerd om zo snel mogelijk te reageren door op een knop te drukken aan de kant waar het doelwit naar toe wijst. De prestatie wordt systematisch gemanipuleerd door (i) het presenteren van aanwijzingen die informatief zijn voor het moment van doelwitpresentatie (centrale aanwijzing) of voor het moment én de locatie van doelwitpresentatie (ruimtelijke aanwijzing) en (ii) door manipulatie van de flankerende stimuli bij het doelwit (neutraal, congruent, incongruent). In totaal 216 trials worden combinaties van condities met blokrandomisatie aangeboden. De meting van reactietijden is gecorrigeerd voor latentietijd van de meetopstelling. Onderzoek naar validiteit wordt beschreven door De Souza Almeida e.a. (2021) en onderzoek naar betrouwbaarheid door Ishigami en Klein (2010). |
| Snelheid van informatieverwerking | De snelheid van reageren op het verschijnen van een doelwit. | Gemiddelde reactietijd (ms) op trials met neutrale doelwitten. | ||
| Interferentiecontrole | De snelheid van het onderdrukken van irrelevante informatie. | Het verschil in de gemiddelde reactietijd (ms) tussen trials met incongruente vs. congruente doelwitten. | ||
| Consistentie van informatieverwerking | De consistentie van het reageren op het verschijnen van een doelwit. | Het gemiddelde van de exponentiële curve in Ex-Gaussian analyse (Massidda, 2013) van de reactietijdsverdeling in alle trials, gecorrigeerd voor type trial. Geeft de invloed van extreem langzame reactietijden op de gemiddelde reactietijd weer. | ||
| Ruimtelijke aandacht | De toename in de snelheid van informatieverwerking door het ruimtelijk oriënteren van de aandacht. | Het verschil in de gemiddelde reactietijd (ms) tussen trials met ruimtelijke vs. centrale aanwijzingen. | ||
| Visual Memory | ||||
| Inprenting in visueel geheugen | Het vermogen om visuele informatie in te prenten in het korttermijngeheugen. | De som van verplaatsingen over de vijf directe reproductie trials. | Location Learning Test, aangepaste versie (Bucks & Willison, 1997) | Een raster (5 x 5) met 10 quasi-willekeurig geplaatste visuele stimuli (het template) wordt vijf keer gepresenteerd op het scherm. De deelnemer dient het template zo goed mogelijk te reproduceren door elke stimulus in een leeg raster te plaatsen, direct na elke presentatie (directe reproductie) en na een interval van 15 minuten (uitgestelde reproductie). De som van verplaatsingen van gereproduceerde stimulilocaties ten opzichte van de stimulilocaties in het template wordt berekend op basis van coördinaten in het raster. In de herkenningsfase wordt elke stimulus weergegeven op de correcte positie en op een incorrecte positie, waarbij de deelnemer dient aan te geven of de weergegeven positie correct of incorrect is voor de betreffende stimulus. Voor herhaalde metingen zijn drie parallelversies beschikbaar. Onderzoek naar validiteit en betrouwbaarheid wordt beschreven door Bucks en Willison (1997), Kessels e.a. (2006) en Kessels e.a. (2016). |
| Consolidatie in visueel geheugen | Het vermogen om visuele informatie te consolideren in het langetermijngeheugen. | Het verschil in de verplaatsingen tussen de herkenningsfase en de laatste directe reproductie trial. | ||
| Dynamische visuomotorische integratie | De precisie van de reactieve visuomotorische respons. | De gemiddelde afstand (in pixels) tussen het doelwit en de muiscursor in de gestructureerde conditie. | Track & Trace task (De Kieviet e.a., 2013) | Zie 'Visuomotische integratie' |
| Verbaal geheugen | ||||
| Inprenting in verbaal geheugen | Het vermogen om verbale informatie in te prenten in het korttermijngeheugen. | De som van correct gereproduceerde woorden gedurende de vijf directe reproductie trials. | 15 Woorden test voor kinderen (Dutch Version) (Kingma & Van den Burg, 2003) | Een lijst van 15 woorden wordt vijf keer auditief aangeboden. De deelnemer dient zo veel mogelijk woorden te reproduceren direct na elke presentatie (directe reproductie) en na een interval van 15 minuten (uitgestelde reproductie). Ten slotte dient de deelnemer de gepresenteerde woorden te herkennen tussen 15 niet eerder gepresenteerde woorden (herkenningsfase). Voor herhaalde metingen zijn drie parallelversies beschikbaar. Onderzoek naar validiteit en betrouwbaarheid wordt beschreven door Kingma en Van den Burg (2003). |
| Consolidatie in verbaal geheugen | Het vermogen om verbale informatie te consolideren in het langetermijngeheugen. | Het verschil in het aantal correct herkende woorden en het aantal gereproduceerde woorden tijdens te laatste directe reproductie trial. | ||
| Visueel werkgeheugen | ||||
| Visuospatieel kortetermijngeheugen | Het vermogen om visuele informatie in te prenten in het visuospatieel kortetermijngeheugen. | Prestatie in de voorwaartse conditie (aantal correct * spanne van de laatste correcte trial). | Klingberg taak (Nutley e.a., 2010) | Een reeks van gele stippen wordt gepresenteerd in een raster (4 x 4). Deelnemers dienen de reeksen te reproduceren in volgorde van presentatie (vooruitconditie) of in omgekeerde volgorde (achteruitconditie), door te klikken op de betreffende locaties in het raster. De moeilijkheidsgraad neemt om elke trial toe, door stapsgewijs de lengte van de reeks toe te laten nemen en de moeilijkheidsgraad van het visuele traject toe te laten nemen. De prestatie in elke conditie wordt bepaald door de spanne (moeilijkheidsgraad van het item van de laatste correcte respons) vermenigvuldigd met de stabiliteit (totaal aantal correcte responsen). Onderzoek naar validiteit en betrouwbaarheid wordt beschreven door Nutley e.a. (2010). |
| Visueel werkgeheugen | Het vermogen om visuele informatie in het werkgeheugen te manipuleren. | Het verschil in prestatie (aantal correct * spanne van de laatste correcte trial) tussen de achterwaartse en voorwaartse conditie. | ||
| Verbal Working Memory | ||||
| Fonologisch kortetermijngeheugen | Het vermogen om verbale informatie in te prenten in het fonologisch kortetermijngeheugen. | Prestatie in de voorwaartse conditie (aantal correct * spanne van de laatste correcte trial). | Cijferreeksen (Wechsler, 1997) | Deelnemers dienen een reeks van getallen die auditief wordt aangeboden te reproduceren in de volgorde van presentatie (vooruitconditie) of in omgekeerde volgorde (achteruitconditie). De moeilijkheidsgraad neemt om de trial toe, door de lengte van de reeks stapsgewijs toe te laten nemen. De prestatie in elke conditie wordt bepaald door de spanne (moeilijkheidsgraad van het item van de laatste correcte respons) vermenigvuldigd met de stabiliteit (totaal aantal correcte responsen). Onderzoek naar validiteit en betrouwbaarheid wordt beschreven door Wechsler (1997). |
| Verbaal werkgeheugen | Het vermogen om verbale informatie in het verbaal werkgeheugen te manipuleren. | Het verschil in prestatie (aantal correct * spanne van de laatste correcte trial) tussen de achterwaartse en voorwaartse conditie. | ||
| Visuomotorische integratie | ||||
| Visuomotorische precisie | De precisie van de proactieve visuomotorische respons. | De gemiddelde afstand (in pixels) tussen het doelwit en de muiscursor in de gestructureerde conditie over de verschillende snelheidsniveaus. | Track & Trace taak (De Kieviet e.a., 2013) | Een bewegend doelwit wordt gepresenteerd op het scherm. Deelnemers worden geïnstrueerd om de muis cursor in het midden van het doelwit te houden in een gestructureerde conditie (een voorspelbaar, circulair pad) en een ongestructureerde conditie (een onvoorspelbaar, willekeurig pad) op vier lineair toenemende snelheden van het doelwit. De cursorpositie wordt gemeten met een gaming muis (1000 Hz verversingsnelheid) en de snelheid van het bewegende doelwit wordt gecorrigeerd voor de verversingssnelheid van het systeem. Onderzoek naar validiteit wordt beschreven door De Kieviet e.a. (2013) en onderzoek naar betrouwbaarheid wordt beschreven door Psotta e.a. (2023). |
| Visuomotorische stabiliteit | De variabiliteit van de proactieve visuomotorische respons. | De standaarddeviatie van het gemiddelde verschil (in pixels) tussen het doelwit en de muiscursor in de gestructureerde conditie over de verschillende snelheidsniveaus. | ||
| Visuomotorische snelheid | De precisie van de visuomotorische respons bij hogere snelheden. | Het verschil in de gemiddelde afstand (in pixels) op het hoogste snelheidsniveau vs. het laagste snelheidsniveau (over de gestructureerde en ongestructureerde condities). | ||
| Motorische responsinhibitie | De snelheid van het onderdrukken van een ingezette motorische respons en het inzetten van een aangepaste visuomotorische respons. | De gemiddelde tijd (ms) na een koerswijziging van het doelwit in de ongestructureerde conditie waarop de maximale afstand tussen het doelwit en de cursor van de muis is geobserveerd. | ||
Dankbetuiging
Deze studie is mogelijk gemaakt met steun van de Hersenstichting.
Literatuur
- Bai, L., Bai, G., Wang, S., Yang, X., Gan, S., Jia, X., Yin, B., & Yan, Z. (2020). Strategic white matter injury associated with long-term information processing speed deficits in mild traumatic brain injury. Human Brain Mapping, 41(15), 4431-4441. https://doi.org/10.1002/HBM.25135.
- Boyle, E., Cancelliere, C., Hartvigsen, J., Carroll, L. J., Holm, L. W., & Cassidy, J. D. (2014). Systematic review of prognosis after mild traumatic brain injury in the military: Results of the international collaboration on mild traumatic brain injury prognosis. Archives of Physical Medicine and Rehabilitation, 95(3 SUPPL). https://doi.org/10.1016/j.apmr.2013.08.297.
- Bucks, R., & Willison, J. (1997). Development and validation of the Location Learning Test (LLT): A test of visuo-spatial learning designed for use with older adults and in dementia. The Clinical Neuropsychologist, 11(3), 273-286. https://doi.org/10.1080/13854049708400456.
- Buysse, D. J., Reynolds, C. F., Monk, T. H., Berman, S. R., & Kupfer, D. J. (1989). The Pittsburgh sleep quality index: A new instrument for psychiatric practice and research. Psychiatry Research. https://doi.org/10.1016/0165-1781(89)90047-4.
- Cassetta, B. D., Cairncross, M., Brasher, P. M. A., Panenka, W. J., & Silverberg, N. D. (2021). Avoidance and endurance coping after mild traumatic brain injury are associated with disability outcomes. Rehabilitation Psychology, 66(2), 160-169. https://doi.org/10.1037/REP0000372.
- Christensen, L. (1986). A method of assessing change in a single subject: An alteration of the RC index. Behavioral Therapy. https://cir.nii.ac.jp/crid/1571135650344714880.
- Clark, C. N., Edwards, M. J., Ong, B. E., Goodliffe, L., Ahmad, H., Dilley, M. D., Betteridge, S., Griffin, C., & Jenkins, P. O. (2022). Reframing postconcussional syndrome as an interface disorder of neurology, psychiatry and psychology. Brain, 145(6), 1906-1915. https://doi.org/10.1093/BRAIN/AWAC149.
- Cohen, J. (1988). Statistical power analysis for the behavioral science. Erlbaum.
- De Kieviet, J. F., Stoof, C. J. J., Geldof, C. J., Smits, N., Piek, J. P., Lafeber, H. N., Van Elburg, R. M., & Oosterlaan, J. (2013). The crucial role of the predictability of motor response in visuomotor deficits in very preterm children at school age. Developmental Medicine and Child Neurology, 55(7), 624-630. https://doi.org/10.1111/dmcn.12125.
- De Koning, M. E., Spikman, J. M., Coers, A., Schönherr, M. C., & Van der Naalt, J. (2015). Pathways of care the first year after moderate and severe traumatic brain injury: Discharge destinations and outpatient follow-up. Brain Injury, 29(4), 423-429. https://doi.org/10.3109/02699052.2014.982188.
- De Souza Almeida, R., Faria-Jr, A., & Klein, R. M. (2021). On the origins and evolution of the Attention Network Tests. https://doi.org/10.1016/j.neubiorev.2021.02.028.
- Echemendia, R., Meeuwisse, W., McCrory, P., Davis, D., Putukian, M., Leddy, J., Makdissi, M., Sullivan, S., Broglio, S., Raftery, M., Schneider, K., Kissick, J., McCrea, M., Dvorak, J., Sills, A., Aubry, M., Engebretsen, L., Loosemoore, M., Fuller, G., … Herring, S. (2017). The sport concussion assessment tool 5th edition (SCAT5): Background and rationale. British Journal of Sports Medicine, 51(11), 848-850.
- Espay, A. J., Norris, M. M., Eliassen, J. C., Dwivedi, A., Smith, M. S., Banks, C., Allendorfer, J. B., Lang, A. E., Fleck, D. E., Linke, M. J., & Szaflarski, J. P. (2015). Placebo effect of medication cost in Parkinson disease: A randomized double-blind study. Neurology, 84(8), 794-802. https://doi.org/10.1212/WNL.0000000000001282/SUPPL_FILE/TABLE_E-3.XLS.
- Fan, J., McCandliss, B. D., Sommer, T., Raz, A., & Posner, M. I. (2002). Testing the efficiency and independence of attentional networks. Journal of Cognitive Neuroscience, 14(3), 340-347. https://doi.org/10.1162/089892902317361886.
- Feigin, V. L., Theadom, A., Barker-Collo, S., Starkey, N. J., McPherson, K., Kahan, M., Dowell, A., Brown, P., Parag, V., Kydd, R., Jones, K., Jones, A., & Ameratunga, S. (2013). Incidence of traumatic brain injury in New Zealand: A population-based study. Lancet Neurology, 12(1), 53-64. https://doi.org/10.1016/S1474-4422(12)70262-4.
- Groenewold, R., & Verheij, N. (2019). Pilotstudie naar CFX-behandeling [Ongepubliceerde studie]. In: Toegepast gezondheidsonderzoek, Universitair Medisch Centrum Groningen.
- Ishigami, Y., & Klein, R. M. (2010). Repeated measurement of the components of attention using two versions of the Attention Network Test (ANT): Stability, isolability, robustness, and reliability. Journal of Neuroscience Methods, 190(1), 117-128. https://doi.org/10.1016/J.JNEUMETH.2010.04.019.
- Kaldenberg, J., Newman, R., Jimenez, C., & Walker, M. (2022). Vestibulo-ocular interventions to support occupational performance for people with traumatic brain injury with visual symptoms (June 2013-October 2020). The American Journal of Occupational Therapy, 76(suppl. 2). https://doi.org/10.5014/AJOT.2022/76S2007.
- Katz, B., Shah, P., & Meyer, D. E. (2017). How to play 20 questions with nature and lose: Reflections on 100 years of brain-training research. Proceedings of the National Academy of Sciences of the United States of America, 115(40), 9897-9904. https://doi.org/10.1073/pnas.1617102114.
- Kessels, R. P. C., Bucks, R. S., Willison, J. R., & Byrne, L. M. . (2016). Handleiding: LLT Location Learning Test Herziene uitgave. Hogrefe.
- Kessels, R. P. C., Nys, G. M. S., Brands, A. M. A., Van den Berg, E., & Van Zandvoort, M. J. E. (2006). The modified Location Learning Test: Norms for the assessment of spatial memory function in neuropsychological patients. Archives of Clinical Neuropsychology, 21(8), 841-846. https://doi.org/10.1016/J.ACN.2006.06.015.
- Kingma, A., & Van den Burg, W. (2003). Drie parallelversies van de 15-woordentest voor kinderen: Handleiding en normering.Universitair Medisch Centrum Groningen.
- Königs, M., Verhoog, E. M., & Oosterlaan, J. (2021). Exploring the neurocognome: Neurocognitive network organization in healthy young adults. Cortex. https://doi.org/10.1016/j.cortex.2021.06.011.
- Leddy, J. J., Burma, J. S., Toomey, C. M., Hayden, A., Davis, G. A., Babl, F. E., Gagnon, I., Giza, C. C., Kurowski, B. G., Silverberg, N. D., Willer, B., Ronksley, P. E., & Schneider, K. J. (2023). Rest and exercise early after sport-related concussion: A systematic review and meta-analysis. British Journal of Sports Medicine, bjsm.Bmj.Com, 57(12), 762-770. https://doi.org/10.1136/bjsports-2022-106676.
- Massidda, D. (2013). Retimes: Reaction time analysis. R package version 0.1-2.
- Mucha, A., Collins, M. W., Elbin, R. J., Furman, J. M., Troutman-Enseki, C., Dewolf, R. M., Marchetti, G., & Kontos, A. P. (2014). A brief vestibular/ocular motor screening (VOMS) assessment to evaluate concussions: Preliminary findings. American Journal of Sports Medicine, 42(10), 2479-2486. https://doi.org/10.1177/0363546514543775.
- Nederlandse Vereniging voor Revalidatieartsen. (2023). Conceptrichtlijn licht traumatisch hersenletsel en postcommotioneel syndroom in de chronische fase.
- Nelson, L. D., Temkin, N. R., Dikmen, S., Barber, J., Giacino, J. T., Yuh, E., Levin, H. S., McCrea, M. A., Stein, M. B., Mukherjee, P., Okonkwo, D. O., Diaz-Arrastia, R., Manley, G. T., Adeoye, O., Badjatia, N., Boase, K., Bodien, Y., Bullock, M. R., Chesnut, R., … Zafonte, R. (2019). Recovery after mild traumatic brain injury in patients presenting to US Level I Trauma Centers: A transforming research and clinical knowledge in traumatic brain injury (TRACK-TBI) Study. JAMA Neurology, 76(9), 1049-1059. https://doi.org/10.1001/JAMANEUROL.2019.1313.
- Nutley, S. B., Söderqvist, S., Bryde, S., Humphreys, K., & Klingberg, T. (2010). Measuring working memory capacity with greater precision in the lower capacity ranges. Developmental Neuropsychology, 35(1), 81-95. https://doi.org/10.1080/87565640903325741.
- Ongaro, G., & Kaptchuk, T. J. (2019). Symptom perception, placebo effects, and the Bayesian brain. Pain, 160(1), 1. https://doi.org/10.1097/J.PAIN.0000000000001367.
- Post, M. W. M., Van Der Zee, C. H., Hennink, J., Schafrat, C. G., Visser-Meily, J. M. A., & Van Berlekom, S. B. (2012). Validity of the Utrecht scale for evaluation of rehabilitation- participation. Disability and Rehabilitation. https://doi.org/10.3109/09638288.2011.608148.
- Psotta, R., Dostál, D., Sarvestan, J., Prycl, D., Kašpar, O., & Křížová, I. (2023). Evaluation of predictive motor control with two touchscreen tablet-based tests: Reliability and validity in school-aged children. Perceptual and Motor Skills, 130(1), 283-300. https://doi.org/10.1177/00315125221130815/ASSET/IMAGES/LARGE/10.1177_00315125221130815-FIG2.JPEG.
- Schreurs, P., Van de Willige, G., & Brosschot, J. (1993). De Utrechtse Copinglijst: UCL. Omgaan met problemen en gebeurtenissen. Swets en Zeitlinger.
- Semkovska, M., Quinlivan, L., O'Grady, T., Johnson, R., Collins, A., O'Connor, J., Knittle, H., Ahern, E., & Gload, T. (2019). Cognitive function following a major depressive episode: A systematic review and meta-analysis. The Lancet Psychiatry, 6(10), 851-861. https://doi.org/10.1016/S2215-0366(19)30291-3.
- Teasdale, G., & Jennett, B. (1974). Assessment of coma and impaired consciousness: A practical scale. Lancet, 2, 81-84.
- Van der Naalt, J., Timmerman, M. E., De Koning, M. E., Van der Horn, H. J., Scheenen, M. E., Jacobs, B., Hageman, G., Yilmaz, T., Roks, G., & Spikman, J. M. (2017). Early predictors of outcome after mild traumatic brain injury (UPFRONT): An observational cohort study. The Lancet Neurology. https://doi.org/10.1016/S1474-4422(17)30117-5.
- Veiligheid.nl (2013). Factsheet Traumatisch hersenletsel.
- Vercoulen, J., Swannik, C., Fennis, J., Galama, J., Van der Meer, J., & Bleijenberg, G. (1999). Checklist Individuele Spankracht (CIS). Gedragstherapie.
- Verheul, R., Andrea, H., Berghout, C. C., Dolan, C., Busschbach, J. J. V., Van der Kroft, P. J. A., Bateman, A. W., & Fonagy, P. (2008). Severity Indices of Personality Problems (SIPP-118): Development, factor structure, reliability, and validity. Psychological Assessment. https://doi.org/10.1037/1040-3590.20.1.23.
- Wartolowska, K. A., Gerry, S., Feakins, B. G., Collins, G. S., Cook, J., Judge, A., & Carr, A. J. (2017). A meta-analysis of temporal changes of response in the placebo arm of surgical randomized controlled trials: An update. Trials, 18(1). https://doi.org/10.1186/S13063-017-2070-9.
- Wechsler, D. (1997). WAIS-III: Wechsler adult intelligence scale. Psychological Corporation San Antonio, TX.
- Wijenberg, M. L. M., Stapert, S. Z., Verbunt, J. A., Ponsford, J. L., Van Heugten, C. M., & Wijenberg, L. M. (2017). Does the fear avoidance model explain persistent symptoms after traumatic brain injury? Taylor & Francis, 31(12), 1597-1604. https://doi.org/10.1080/02699052.2017.1366551.
- Wilson, J. T. L., Pettigrew, L. E. L., & Teasdale, G. M. (2009). Structured interviews for the Glasgow Outcome Scale and the Extended Glasgow Outcome Scale: Guidelines for their use. Https://Home.Liebertpub.Com/Neu, 15(8), 573-580. https://doi.org/10.1089/NEU.1998.15.573.
- Wing, B. H., Tucker, B. J., Fong, A. K., & Allen, M. D. (2017). Developing the standard of care for post-concussion treatment: Neuroimaging-guided rehabilitation of neurovascular coupling. The Open Neuroimaging Journal. https://doi.org/10.2174/1874440001711010058.
- Woodrow, R. E., Winzeck, S., Luppi, A. I., Kelleher-Unger, I. R., Spindler, L. R. B., Wilson, J. T. L., Newcombe, V. F. J., Coles, J. P., Mri, C.-T., Participants, S., Menon, D. K., Stamatakis, E. A., & Woodrow, R. (2023). Acute thalamic connectivity precedes chronic post-concussive symptoms in mild traumatic brain injury. Brain, 146(8), 3484-3499. https://doi.org/10.1093/brain/awad056.
- Zigmond, A. S., & Snaith, R. P. (1983). The Hospital Anxiety and Depression Scale. Acta Psychiatrica Scandinavica. https://doi.org/10.1111/j.1600-0447.1983.tb09716.x.
 © 2009-2026 Uitgeverij Boom Amsterdam
© 2009-2026 Uitgeverij Boom Amsterdam
ISSN 1871-1391
De artikelen uit de (online)tijdschriften van Uitgeverij Boom zijn auteursrechtelijk beschermd. U kunt er natuurlijk uit citeren (voorzien van een bronvermelding) maar voor reproductie in welke vorm dan ook moet toestemming aan de uitgever worden gevraagd:
Behoudens de in of krachtens de Auteurswet van 1912 gestelde uitzonderingen mag niets uit deze uitgave worden verveelvoudigd, opgeslagen in een geautomatiseerd gegevensbestand, of openbaar gemaakt, in enige vorm of op enige wijze, hetzij elektronisch, mechanisch door fotokopieën, opnamen of enig andere manier, zonder voorafgaande schriftelijke toestemming van de uitgever.
Voor zover het maken van kopieën uit deze uitgave is toegestaan op grond van artikelen 16h t/m 16m Auteurswet 1912 jo. Besluit van 27 november 2002, Stb 575, dient men de daarvoor wettelijk verschuldigde vergoeding te voldoen aan de Stichting Reprorecht te Hoofddorp (postbus 3060, 2130 KB, www.reprorecht.nl) of contact op te nemen met de uitgever voor het treffen van een rechtstreekse regeling in de zin van art. 16l, vijfde lid, Auteurswet 1912.
Voor het overnemen van gedeelte(n) uit deze uitgave in bloemlezingen, readers en andere compilatiewerken (artikel 16, Auteurswet 1912) kan men zich wenden tot de Stichting PRO (Stichting Publicatie- en Reproductierechten, postbus 3060, 2130 KB Hoofddorp, www.cedar.nl/pro).
No part of this book may be reproduced in any way whatsoever without the written permission of the publisher.
Nieuwsbrief Boom Psychologie & Psychiatrie
Meld u nu aan en ontvang maandelijks de nieuwsbrief van Boom Psychologie & Psychiatrie met aantrekkelijke aanbiedingen en de nieuwe uitgaven.
Aanmelden