De relatie tussen cognitieve prestaties en klinische stadiëring bij schizofreniespectrumstoornissen: Een prospectieve zesjarige follow-upstudie
Samenvatting
Achtergrond
Klinische stadiëring is ontwikkeld om de heterogeniteit in schizofreniespectrumstoornissen te beschrijven. In deze studie wordt onderzocht of cognitieve functies geassocieerd zijn met klinische stadia. Ook wordt bekeken of cognitieve prestaties bij baseline geassocieerd zijn met een stadiumovergang bij follow-up.
Methode
We pasten het stadiëringsmodel van Fusar-Poli e.a. (2017) toe bij 927 patiënten met schizofreniespectrumstoornissen, zoals bepaald bij baseline en drie en zes jaar follow-up. Cognitieve functies werden in kaart gebracht met een standaard neuropsychologische testbatterij. Gegeneraliseerde lineair gemengde modellen werden gebruikt om associaties van cognitieve prestaties met stadiëring en stadiumovergang bij follow-up te onderzoeken.
Resultaten
De resultaten lieten zien dat hogere stadia significant geassocieerd waren met een lagere verwerkingssnelheid en lagere scores in het werkgeheugen. Er werden geen associaties gevonden tussen baseline cognitieve parameters en stadiumovergang van baseline tot follow-up.
Conclusie
We concluderen dat er een relatie lijkt te zijn tussen een lagere verwerkingssnelheid en het werkgeheugen met hogere stadia van ziekte bij schizofreniespectrumstoornissen; het includeren van deze variabelen draagt dus in enige mate bij aan een verbetering van de klinische validiteit. De associaties waren echter klein en we vonden geen bewijs dat cognitieve prestaties bijdragen aan het voorspellen van het klinisch stadium bij follow-up.
Inleiding
Een relatief nieuwe benadering voor het verfijnen van de classificatie van schizofreniespectrumstoornissen is klinische stadiëring. Het stadiëringsmodel beschrijft stadia aan de hand van het aantal psychotische episodes, de mate van bereikte remissie en het niveau van functioneren. Daardoor wordt onderscheid gemaakt tussen vroege en late stadia van de ziekte, waarin patiënten tijdens het ziektebeloop kunnen overgaan naar meer en minder ernstige stadia, afhankelijk van het psychiatrische toestandsbeeld (McGorry, 2007; McGorry e.a., 2010). In een recenter artikel, waarin een herzien stadiëringsmodel wordt gepresenteerd (Fusar-Poli e.a., 2017) beschrijven de auteurs de operationalisatie per klinisch stadium, variërend van klinisch hoog risico op psychose, eerste of terugkerende psychose, tot chronische ziekte. Het model kan een rol spelen bij snelle herkenning, vroege interventie en behandeling om de overgang naar meer gevorderde stadia te voorkomen.
Cognitieve tekorten zijn vaak al in de kindertijd aanwezig bij patiënten die later een psychose ontwikkelen (Kahn & Keefe, 2013). Rond het optreden van de eerste episode van psychose (EEP) lijkt enige stabilisatie van cognitieve prestaties op te treden (Bora & Murray, 2014). De relatie tussen de ernst van psychopathologie en cognitieve prestaties na de EEP is echter nog verre van duidelijk. Twee meta-analyses op dit gebied lieten matige associaties zien tussen desorganisatie en negatieve symptomen met cognitieve tekorten bij patiënten met schizofrenie (Ventura e.a., 2009; Ventura e.a., 2010). Daarentegen vonden Rund e.a. (2007, 2016) in twee studies dat recidiverende en aanhoudende psychotische episodes niet geassocieerd waren met cognitief functioneren bij patiënten met schizofrenie. Daarbij ontdekten dezelfde auteurs dat stabiele remissie (geen psychotische symptomen) tijdens het eerste jaar van psychose geassocieerd was met verbeterde cognitieve prestaties op de lange termijn (Rund e.a., 2016). Bovendien was een verhoogd aantal recidief psychoses binnen het eerste jaar geassocieerd met lagere scores op werkgeheugen en verbaal leren (Rund e.a., 2007). Aangezien het stadiëringsmodel is gebaseerd op remissiestatus, recidieven en chroniciteit, rijst de vraag of het toevoegen van cognitieve prestaties aan het stadiëringsmodel de klinische validiteit ervan zou kunnen verbeteren.
Voor zover we weten evalueerden tot op heden slechts drie studies de cognitieve prestaties binnen het stadiëringsmodel. De eerste studie van Godin e.a. (2019) liet zien dat gevorderde ziektestadia werden gekenmerkt door een lagere verwerkingssnelheid en ernstigere beperkingen in de uitvoerende functies. Daarentegen vonden Tedja e.a. (2017) geen significante verschillen op de meeste cognitieve subtests tussen stadia bij poliklinische patiënten met een stoornis in het schizofreniespectrum. Evenmin droegen cognitieve parameters op baseline bij aan het voorspellen van verandering van stadium bij een follow-up van drie jaar (Tedja e.a., 2017). De inconsistente bevindingen tussen voorgaande studies kan mogelijk verklaard worden door onvoldoende beschikbare data bij de studie van Tedja e.a. (2017) om het stadium te bepalen. De laatste studie op dit vlak liet een afname van het algemeen cognitief functioneren zien in meer gevorderde ziektestadia ten opzichte van vroege stadia bij acuut opgenomen patiënten met schizofreniespectrumstoornissen (Berendsen e.a., 2021). We verwachten dat klinisch opgenomen patiënten ernstiger zijn aangedaan wat betreft cognitief functioneren en psychopathologie. Bovengenoemde studies waren echter cross-sectioneel of hadden een kortdurende follow-up, en zijn dus minder geschikt om de associatie tussen stadiumovergang en cognitief functioneren in kaart te brengen. Concluderend is er tot op heden slechts beperkt en inconsistent bewijs beschikbaar met betrekking tot de relatie tussen cognitieve prestaties en klinische stadiëring bij schizofreniespectrumstoornissen.
Het doel van onze studie is dan ook om aan de hand van een grote steekproef van patiënten met schizofreniespectrumstoornissen die zes jaar gevolgd zijn, te onderzoeken of cognitieve parameters geassocieerd zijn met klinische stadia. Ook zullen we nagaan of cognitieve markers bij baseline geassocieerd zijn met stadiumovergang bij drie en zes jaar follow-up. We verwachten dat meer gevorderde stadia van ziekte geassocieerd zijn met verminderde cognitieve prestaties en dat lagere prestaties op cognitieve tests bij baseline geassocieerd zullen zijn met de overgang naar ernstigere klinische stadia bij follow-up.
Methode
Studiedesign
De huidige studie werd uitgevoerd binnen het multicenter Genetic Risk and Outcome of Psychosis (GROUP)-cohortstudie (Korver e.a., 2012). Geïncludeerde patiënten werden gediagnosticeerd met schizofreniespectrumstoornissen en geworven bij vier universitaire studielocaties en regionale ggz-instellingen in Nederland en België. De classificatie werd gesteld door middel van het instrument de Comprehensive Assessment of Symptoms and History (CASH). De CASH beoordeelt de ernst van positieve symptomen (34 items) en negatieve symptomen (21 items) gemeten op een ordinale schaal van 0 (afwezig) tot 5 (ernstig). Box 1 geeft informatie over welke classificaties onder de groep schizofreniespectrumstoornissen vallen. Een kenmerk in deze groep is dat alle patiënten voor een bepaalde tijd ernstige klachten van hallucinaties en/of wanen met disfunctioneren hebben gehad. Er zit variatie tussen de classificaties in duur van de klachten, of er sprake is van affectieve, katatone symptomen, desorganisatie en potentiële oorzaak van de psychotische symptomen. In de huidige studie is een brede selectie van classificaties geïncludeerd. De totale steekproef bestond uit 1119 patiënten op baseline. Na de baselinemeting werden patiënten na drie en zes jaar uitgenodigd voor twee follow-upmetingen. Getrainde onderzoekers voerden klinische interviews uit met patiënten en namen de vragenlijsten af. De training van de onderzoekers bestond uit een driedaagse bijeenkomst om te oefenen met de observationele instrumenten, de training werd elke twee maanden opnieuw gegeven. De trainingsprocedure bestond uit didactische sessies, observatie en daadwerkelijke oefening onder supervisie. De interviewers waren onderzoeksassistenten, psychologen, psychiaters, verpleegkundigen en promovendi.
Box 1 Classificaties schizofreniespectrumstoornissen
Schizofrenie
Schizoaffectieve stoornis
Ongespecificeerde schizofreniespectrumstoornis
Andere schizofreniespectrumstoornis
Schizofreniforme stoornis
Waanstoornis
Kortdurende psychotische stoornis
Psychotische stoornis door een somatische aandoening
Psychotische stoornis door middelen
Stadiëring
In Tabel 1 passen we het onlangs voorgestelde stadiëringsmodel van Fusar-Poli e.a. (2017) toe op onze dataset met behulp van vier variabelen:
- definitie van remissie door Andreasen e.a. (2005), gemeten met de Positive and Negative Syndrome Scale (PANSS);
- Global Assessment of Functioning (GAF);
- totaal aantal doorgemaakte psychotische episodes;
- chroniciteitsfactor (Peralta & Cuesta, 1994; Aas, 2011; Fusar-Poli e.a., 2017; Susser e.a., 2000).
De chroniciteitsfactor beschrijft de ernst en continuïteit van de psychose. We gebruikten score 5 en 6 van de chroniciteitsfactor, waarbij score 5 verwijst naar chronische ziekte, continue psychose met milde symptomatologie en score 6 staat voor een chronische ziekte, continue psychose met matige of ernstige symptomatologie. We verdeelden stadium 2 in drie substadia, namelijk stadium 2A, gedefinieerd als de eerste episode van psychose (EEP) met symptomatische remissie en een GAF-score > 70, stadium 2B EEP – onvolledige remissie, en stadium 2C EEP – momenteel psychotisch met GAF-score < 70. Op basis van recente onderzoeksresultaten (Berendsen e.a., 2022) hebben we stadium 3B onderverdeeld in stadium 3B-1 (recidiverende psychose met meer dan twee episodes en momenteel in symptomatische remissie) en 3B-2 (meerdere episodes en momenteel psychotisch). Voor gedetailleerde informatie verwijzen wij naar Tabel 1. Voor de multi-cross-sectionele analyses hebben we het aantal stadia verminderd om een adequate modelfit te garanderen. In stadium 2 namen we patiënten op met een eerste episode van psychose (stadium 2A, 2B en 2C). In stadium 3 includeerden we patiënten met een enkele terugval in een psychotische stoornis (stadium 3A), meerdere recidieven in symptomatische remissie en momenteel psychotisch (stadium 3B1 en 3B2), en stadium 4 bleef onveranderd.
Tabel 1 Het aangepaste stadiëringsmodel van Fusar-Poli
| Stadiëringsmodel | Operationalisering | |
|---|---|---|
| Stadium 2A | Eerste episode van psychose – momenteel in symptomatische remissie | - Eén psychotische episode - Symptomatische remissie + GAF > 70 - Chroniciteitsindicatorscores < 5 |
| Stadium 2B | Eerste episode van psychose – onvolledige remissie | - Eén psychotische episode - Symptomatische remissie + GAF symptomen < 70 - Chroniciteitsindicatorscores < 5 |
| Stadium 2C | Eerste episode van psychose – momenteel psychotisch | - Eén psychotische episode - Psychotisch tijdens de meting + GAF symptomen < 70 - Chroniciteitsindicatorscores < 5 |
| Stadium 3A | Eenmalige terugval in een psychotische stoornis | - Twee psychotische episodes - Psychotisch tijdens meting of symptomatische remissie - Chroniciteitsindicatorscores < 5 |
| Stadium 3B-1 | Meerdere recidieven, symptomatische remissie | > twee psychotische episodes - Symptomatische remissie - Chroniciteitsindicatorscores <5 |
| Stadium 3B-2 | Meerdere recidieven, momenteel psychotisch | > twee psychotische episodes - Psychotisch tijdens de meting - Chroniciteitsindicatorscores < 5 |
| Stadium 4 | Chronische psychose met ernstige aanhoudende ziekte | - Geen remissie - Chroniciteitsindicator score 5 of 6: chronische ziekte met milde of meestal ernstige symptomatologie |
Definitie van stadiumovergang bij follow-up
Om het beloop van patiënten over de tijd te bepalen gebruikten we het oorspronkelijke stadiëringsmodel, zoals beschreven door Fusar-Poli. Stadiumovergang werd geoperationaliseerd als verslechterd, verbeterd of stabiel. Stabiel impliceert geen verandering in stadium bij follow-up. We bepaalden de overgang (verbetering, stabiel of afname) in stadia tussen baseline (T0) versus driejarige follow-up (T1) en baseline (T0) versus zesjarige (T2) follow-up. Patiënten van wie geen baseline-stadiëringsgegevens beschikbaar waren en van wie niet ten minste één follow-upmeting bekend was, werden uitgesloten van de longitudinale analyse.
Cognitieve parameters
Neuropsychologisch onderzoek omvatte een testbatterij gericht op het vaststellen van het functioneren binnen cognitiedomeinen die geassocieerd zijn met psychotische stoornissen (volgens MATRICS Consensus Cognitive Battery). Subtests van de WAIS-III werden gebruikt om de domeinen verwerkingssnelheid (symboolsubstitutie), werkgeheugen (rekenen), redeneren en probleemoplossing (blokpatronen) te meten. Verbaal geheugen werd gemeten met de Auditieve Verbale Leertest, met als uitkomstmaat de onmiddellijke reproductie en het percentage onthouden na twintig minuten. De Continuous Performance Test (CPT) werd afgenomen om het domein aandacht/alertheid te testen, waarvoor we de gemiddelde score van de algehele nauwkeurigheid en de gemiddelde reactietijd gebruikten (Firth e.a., 2017). De tests werden in een vaste volgorde afgenomen, de testtijd was ongeveer negentig tot honderdtwintig minuten. Standaardisatie van ruwe scores van cognitieve tests werd gedaan door z-transformatie.
Statistische analyses
Afhankelijk van het type data werden verschillen tussen stadia met betrekking tot baseline klinische en demografische kenmerken getoetst met onafhankelijke t-tests (twee groepen met continue variabelen), variantieanalyses (drie of meer groepen met continue variabelen) of chi-kwadraattests (categoriale variabelen). Om te bepalen welke cognitieve domeinen significant geassocieerd waren met klinische stadia in de loop van de tijd en cross-sectioneel, voerden we gegeneraliseerde lineaire gemengde modellen (GLMM) uit met stadiëring als afhankelijke variabele en elk cognitief domein als vast effect, en a priori geselecteerde covariaten. Voor de cross-sectionele analyse werden patiënten in de analyses opgenomen als er gedurende ten minste één tijdstip (baseline, drie jaar of zes jaar) gegevens beschikbaar waren over de uitkomstvariabele, omdat gemengde modellering het mogelijk maakt om adequate schattingen te geven als gegevens voor één of twee tijdspunten ontbreken. Voor verdere details over de statistische analyses wordt verwezen naar het oorspronkelijke artikel (Berendsen e.a., 2022). In alle analyses werden p-waarden berekend met de Kenward-Roger-benadering en bonferroni-gecorrigeerde post-hocanalyses werden uitgevoerd als een significant effect werd gevonden. We selecteerden verschillende confounders op basis van hun a priori associatie met cognitieve achteruitgang of symptomatische uitkomst bij schizofreniespectrumstoornissen. We gebruikten de covariaten leeftijd, geslacht (man of vrouw), gebruik van antipsychotische medicatie (ja of nee) en opleidingsniveau (primair, secundair of hoger) in de primaire analyse (Omachi & Sumiyoshi, 2018; Husa e.a., 2017). Statistische analyses werden uitgevoerd met Statistical Package for Social Sciences (SPSS) versie 26. Voor de analyses is datarelease 7.0 gebruikt.
Resultaten
Kenmerken van de steekproef
Gedetailleerde klinische en demografische informatie is weergegeven in Tabel 2 (p. 8). We vonden significante verschillen tussen stadia in leeftijd (F (dF = 5, N = 927) = 11,334, p < 0,001) en opleidingsniveau (X2 (dF = 10, N = 925) = 42,200, p < 0,001). Bij baseline includeerden we 927 patiënten, bij drie jaar follow-up 661 patiënten en zes jaar follow-up 547 patiënten. Reden voor exclusie was een of meer ontbrekende variabelen die nodig waren voor stadiumtoewijzing. Patiënten die niet aan een van de stadia konden worden toegewezen, verschilden niet significant van de rest van het cohort in ziekteduur of de onderzochte cognitieve domeinen. Ze werden echter gekenmerkt door significant lagere leeftijd (T = 2,361, p = 0,018), hogere GAF-scores (T = 3,223, p = 0,001) en een lager aantal episodes (T = 0,015, p = 0,001).
Tabel 2 Baseline klinische en demografische kenmerken
| Stadium 2A (n = 91) | Stadium 2B (n = 132) | Stadium 2C (n = 213) | Stadium 3A (n = 218) | Stadium 3B-1 (n = 83) | Stadium 3B-2 (n = 62) | Stadium 4 (n = 128) | Tussen groepen | Df | P-waarde | |
|---|---|---|---|---|---|---|---|---|---|---|
| Leeftijd (SD) | 26,8 (7,4) | 25,8 (6,3) | 25,0 (6,4) | 28,5 (7,3) | 30,0 (8,6) | 27,7 (7,0) | 29,7 (7,7) | 11,334 | 5 | < 0,001 |
| Geslacht % vrouw | 34,1% | 21,2% | 17,2% | 19,3% | 32,5% | 19,4% | 20,3% | 17,258 | 6 | 0,008 |
| Antipsychotische medicatie | ||||||||||
| % gebruikers | 78 ,0% | 91,7% | 93,0% | 87,6% | 91,6% | 90,3% | 92,2% | 41,220 | 18 | 0, 001 |
| % niet-gebruikers | 0,0% | 0,0% | 0,5% | 1,4% | 0,0% | 0,0% | 0,0% | |||
| % onbekend | 1,1% | 2,3% | 4,7% | 4,1% | 0,0% | 1,6% | 4,7% | |||
| % ontbreekt | 20,9% | 6,1% | 1,9% | 6,9% | 8,4% | 8,1% | 3,1% | |||
| Opleidingsniveau | 51,226 | 12 | < 0,001 | |||||||
| % primair | 4,4% | 10,6% | 16,4% | 10,6% | 7,2% | 12,9% | 25,0% | |||
| %secundair | 49,5% | 50,0% | 48,4% | 43,1% | 43,4% | 61,3% | 54,7% | |||
| % hoger | 46,2% | 39,4% | 35,2% | 46,3% | 49,4% | 25,8% | 20,3% |
Stadiumbeloop
We hadden voldoende gegevens om het ziektestadium te bepalen van 595 patiënten bij drie jaar follow-up en van 497 patiënten bij zes jaar follow-up. Bij drie jaar follow-up bleef 40,7% (N = 242) van de patiënten stabiel in termen van stadia, 15,8% verbeterde (N = 94) en 43,5% (N = 259) verslechterde in stadiëring in vergelijking met baseline. Bij een follow-up van zes jaar ten opzichte van baseline bleef 32,0% (N = 159) stabiel, verbeterde 15,5% (N = 77) en verslechterde 52,5% (N = 261).
Associatie van cognitieve prestaties met klinische stadia
Prestaties op de cognitieve tests in de samengevoegde stadia worden weergegeven in Figuur 1a, b en c (p. 9). Associaties tussen cognitieve domeinen en stadiëring over de tijd worden weergegeven in Tabel 3 (pp. 10-11). We vonden significante associaties voor verwerkingssnelheid (F = 3,688, p = 0,025) en werkgeheugen (F = 6,365, p = 0,002) met klinische stadiëring. Overige cognitieve domeinen waren niet significant geassocieerd met stadiëring. Tabel 3 laat ook zien dat covariaten antipsychotica, leeftijd en opleidingsniveau significant geassocieerd waren met stadia in alle modellen (p < 0,001). Paarsgewijze vergelijkingen met stadium 2 als referentiecategorie zijn weergegeven in Tabel 4 (pp. 11-12). Alleen in stadium 4 werd een significant lagere verwerkingssnelheid gezien (estimate: -0,160, p = 0,035) en een slechtere prestatie op een werkgeheugentaak (estimate = -0,201, p = 0,009), vergeleken met overige stadia en na controle op covariaten. Tabel 5 (p. 12) laat zien dat noch de baseline-verwerkingssnelheid, noch het werkgeheugen significant geassocieerd waren met het stadiumbeloop bij drie en zes jaar follow-up.
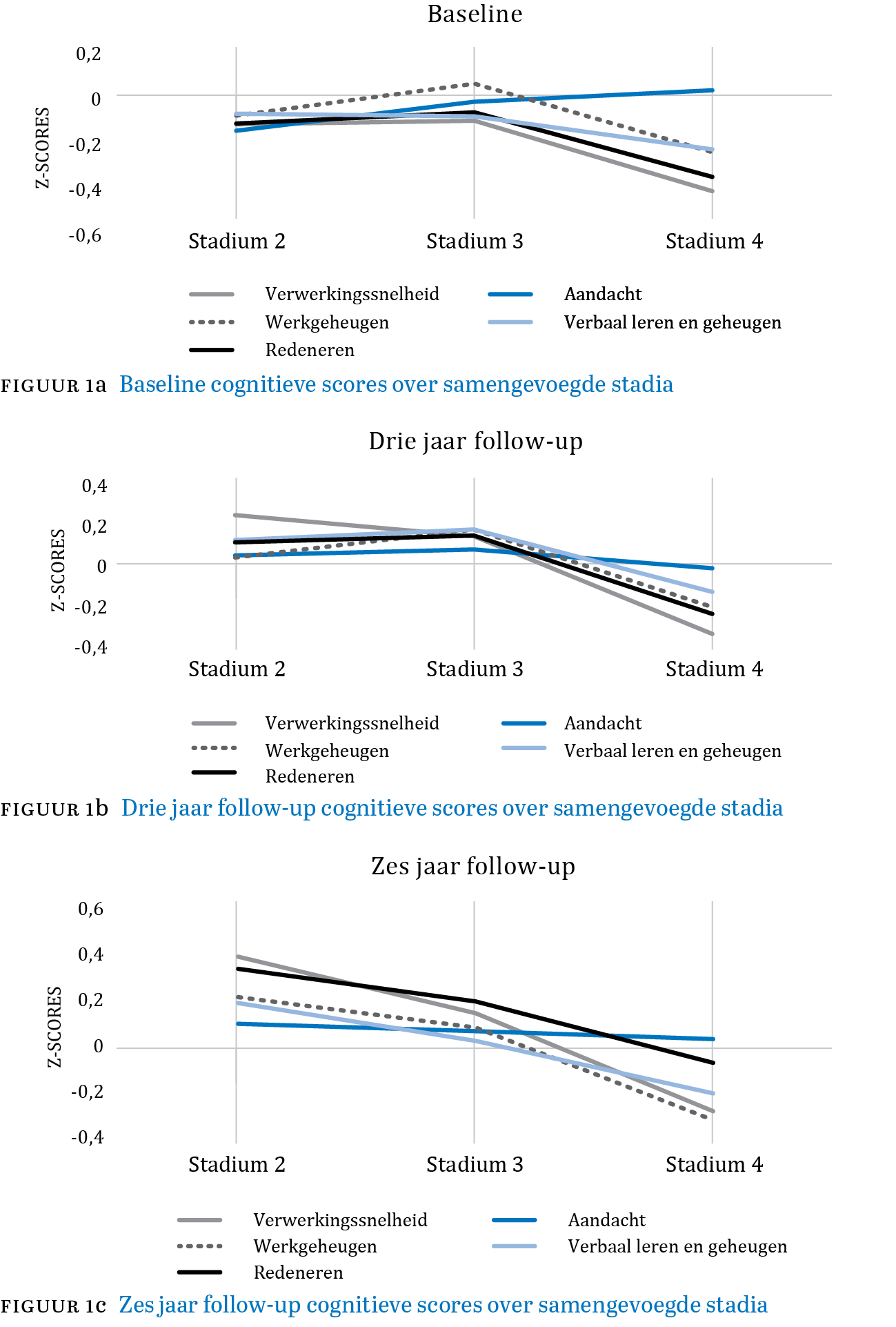
Figuur 1 Cognitieve scores over samengevoegde stadia
Tabel 3 Cross-sectionele associaties tussen klinische stadia en individuele cognitieve subtests
| Klinische stadiëring | F-waarde | p-waarde |
|---|---|---|
| Gecorrigeerd model | 13,256 | < 0,001 |
| Verwerkingssnelheid | 3,688 | 0,025 |
| Opleidingsniveau | 8,636 | < 0,001 |
| Leeftijd | 63,296 | < 0,001 |
| Antipsychotische medicatie | 4,428 | < 0,001 |
| Geslacht | 1,458 | 0,233 |
| Gecorrigeerd model | 13,162 | < 0,001 |
| Aandacht | 0,978 | 0,376 |
| Opleidingsniveau | 13,512 | < 0,001 |
| Leeftijd | 64,464 | < 0,001 |
| Antipsychotische medicatie | 4,682 | < 0,001 |
| Geslacht | 2,644 | 0,071 |
| Gecorrigeerd model | 13,567 | < 0,001 |
| Werkgeheugen | 6,365 | 0,002 |
| Opleidingsniveau | 6,927 | < 0,001 |
| Leeftijd | 66,210 | < 0,001 |
| Antipsychotische medicatie | 4,627 | < 0,001 |
| Geslacht | 3,519 | 0,030 |
| Gecorrigeerd model | 13,177 | < 0,001 |
| Verbaal leren en geheugen | 0,89 | 0,502 |
| Opleidingsniveau | 11,428 | < 0,001 |
| Leeftijd | 66,214 | < 0,001 |
| Antipsychotische medicatie | 4,862 | < 0,001 |
| Geslacht | 2,035 | 0,131 |
| Gecorrigeerd model | 13,315 | < 0,001 |
| Verbaal redeneren | 2,967 | 0,052 |
| Opleidingsniveau | 9,463 | < 0,001 |
| Leeftijd | 66,382 | < 0,001 |
| Antipsychotische medicatie | 4,919 | < 0,001 |
| Geslacht | 2,606 | 0,074 |
Tabel 4 Post-hoctests
| Schatting | Standaard fout | P-waarde | ||
|---|---|---|---|---|
| Stadium 3 | Intercept | -2,365 | 0,3146 | < 0,001 |
| Verwerkingssnelheid | 0,032 | 0,0583 | 0,583 | |
| Opleidingsniveau (primair) | -0,147 | 0,2108 | 0,486 | |
| Opleidingsniveau (secundair) | -0,216 | 0,1151 | 0,060 | |
| Leeftijd | 0,081 | 0,0079 | < 0,001 | |
| Antipsychotische medicatie – niet gebruiken | 0,094 | 0,3716 | 0,801 | |
| Antipsychotische medicatie – gebruik | 0,518 | 0,1523 | 0,001 | |
| Geslacht | -0,010 | 0,1273 | 0,939 | |
| Stadium 4 | Intercept | -5,020 | 0,4486 | < 0,001 |
| Verwerkingssnelheid | -0,160 | 0,0759 | 0,035 | |
| Opleidingsniveau (primair) | 0,984 | 0,2445 | < 0,001 | |
| Opleidingsniveau (secundair) | 0,491 | 0,1570 | 0,002 | |
| Leeftijd | 0,095 | 0,0097 | < 0,001 | |
| Geen antipsychotica | 0,941 | 0,5177 | 0,069 | |
| Antipsychotica | 1,154 | 0,2464 | < 0,001 | |
| Geslacht | 0,259 | 0,1746 | 0,139 | |
| Stadium 3 | Intercept | -2,336 | 0,3022 | < 0,001 |
| Werkgeheugen | 0,056 | 0,0589 | 0,346 | |
| Opleidingsniveau (primair) | -0,139 | 0,2139 | 0,515 | |
| Opleidingsniveau (secundair) | -0,204 | 0,1202 | 0,090 | |
| Leeftijd | 0,080 | 0,0079 | < 0,001 | |
| Geen antipsychotica | 0,177 | 0,3697 | 0,633 | |
| Antipsychotica | 0,527 | 0,1514 | 0,001 | |
| Geslacht | -0,043 | 0,1285 | 0,738 | |
| Stadium 4 | Intercept | -5,255 | 0,4367 | < 0,001 |
| Werkgeheugen | -0,201 | 0,0765 | 0,009 | |
| Opleidingsniveau (primair) | 0,928 | 0,2489 | < 0,001 | |
| Opleidingsniveau (secundair) | 0,423 | 0,1633 | 0,010 | |
| Leeftijd | 0,099 | 0,0096 | < 0,001 | |
| Geen antipsychotica | 0,911 | 0,5217 | 0,081 | |
| Antipsychotica | 1,185 | 0,2460 | < 0,001 | |
| Geslacht | 0,386 | 0,1761 | 0,028 |
Tabel 5 Associaties tussen verandering in stadium bij drie en zes jaar follow-up met baseline cognitieve prestaties
| Fase-overgang | F-waarde | P-waarde |
|---|---|---|
| Gecorrigeerd model | 0,746 | 0,706 |
| Verwerkingssnelheid | 2,444 | 0,087 |
| Werkgeheugen | 0,280 | 0,756 |
| Opleidingsniveau | 0,841 | 0,490 |
| Leeftijd | 3,104 | 0,045 |
| Antipsychotische medicatie | 0,000 | 1,000 |
| Geslacht | 0,050 | 0,951 |
Discussie
In de huidige studie hebben wij de cognitieve prestaties in relatie tot het klinische stadiëringsmodel bij patiënten met schizofreniespectrumstoornissen onderzocht. In overeenstemming met onze hypothese vonden we significante associaties tussen lagere cognitieve prestaties, met name de snelheid van informatieverwerking en werkgeheugen, met het meest gevorderde stadium van ziekte. Deze resultaten bleven bestaan wanneer werd gecorrigeerd voor leeftijd, geslacht en medicatiegebruik. Dit suggereert dat specifieke subgroepen van patiënten met schizofreniespectrumstoornissen met aanhoudende symptomen een lagere snelheid van informatieverwerking en een beperkter werkgeheugen hebben. Het toevoegen van de parameters werkgeheugen en verwerkingssnelheid aan het stadiëringsmodel zou de klinische validiteit in enige mate kunnen verbeteren. Deze cognitieve parameters waren echter niet geassocieerd met stadiumovergang bij een follow-up van drie en zes jaar.
Tot nu toe werd slechts in een beperkt aantal studies de associatie tussen cognitief functioneren en klinische stadia bij schizofreniespectrumstoornissen onderzocht (Berendsen e.a., 2021; Godin e.a., 2019; Tedja e.a., 2017). Twee van deze studies toonden ook een associatie tussen cognitieve tekorten en hogere stadia van ziekte. Onderzoek naar een kleinere substeekproef van GROUP-deelnemers, uitgevoerd door Tedja e.a. (2017), liet zien dat de WAIS-informatiesubtest significant verschilde tussen stadia op baseline, maar hier werd alleen niet gecorrigeerd voor opleidingsniveau. Deze inconsistente resultaten kunnen gedeeltelijk worden verklaard door een relatief lage steekproefomvang, minder follow-upbeoordelingen en strengere inclusiecriteria van Tedja e.a. (2017).
Over de relatie tussen cognitief functioneren en psychopathologie, zoals de ernst van de symptomen, terugval of chroniciteit is al meer bekend. Zo is een associatie gevonden tussen het aantal recidief psychoses en werkgeheugenprestatie. In deze studie was de snelheid van informatieverwerking echter niet geassocieerd met de ernst van psychopathologie of recidieven (Rund e.a., 2007; Rund e.a., 2016). Vanuit een breder perspectief toonde een meta-analyse door Forbes e.a. (2009) aan dat patiënten met schizofrenie met meerdere episodes slechter presteerden op een werkgeheugentaak vergeleken bij patiënten met een eerste episode van schizofrenie. In overeenstemming met onze bevindingen toonde een meta-analyse door Dickinson e.a. (2007) aan dat verwerkingssnelheid geassocieerd is met de ernst van klinische symptomen bij patiënten met schizofrenie. De auteurs stelden zelfs voor dat verwerkingssnelheid een robuust beoordelingsinstrument kan zijn voor patiënten met schizofrenie, gezien de relatie met de functionele uitkomst op lange termijn.
In tegenstelling tot onze verwachting vonden we geen bewijs voor de voorspellende validiteit van cognitieve prestaties in het stadiëringsmodel. De gevonden associaties verklaren slechts een bescheiden deel van de complexe interactie van prognostische factoren die de uitkomst bepalen bij patiënten met schizofreniespectrumstoornissen. Andere factoren zoals de ervaren ondersteuning van familieleden, middelenmisbruik of therapietrouw kunnen sterker verband houden met de chroniciteit en terugval in psychotische symptomen (De Haan e.a., 2007; Weiden e.a., 2004; Alvarez-Jimenez e.a., 2012). Onze resultaten toonden het relatieve belang van werkgeheugen en verwerkingssnelheid voor de gevorderde stadia van de ziekte. Het cognitief funtioneren is sterk geassocieerd met kwaliteit van leven en het niveau van functioneren; het is dan ook belangrijk aandacht te hebben voor cognitieve (dis)functies en zo nodig interventies in te zetten. Verschillende interventies kunnen helpen bij het verbeteren van de cognitieve prestaties bij patiënten met schizofreniespectrumstoornissen. Cognitieve remediatietherapie (CRT) of aerobe oefeningstraining zijn bijvoorbeeld bewezen effectieve interventies om de cognitieve prestaties te verbeteren (Firth e.a., 2017; Vita e.a., 2021). Hierbij is een lagere ernst van de symptomen geassocieerd met een grotere verbetering van het algemeen cognitief functioneren na behandeling; symptomatische remissie is dus van belang om goed van deze behandeling te kunnen profiteren.
Een sterk punt van onze studie is dat we associaties tussen cognitieve prestaties met klinische stadia evalueerden bij schizofreniespectrumstoornissen met een langdurige follow-up en bij een groot cohort van patiënten. Onze studie heeft echter ook drie belangrijke beperkingen. Ten eerste vertegenwoordigen patiënten in de GROUP-studie een relatief hoog functionerende groep patiënten, waardoor de generaliseerbaarheid van de resultaten wordt beperkt. Ten tweede bleek het niet mogelijk om het oorspronkelijke stadiëringsmodel zoals voorgesteld door Fusar-Poli e.a. (2017) op te nemen in de statistische analyse. Om een adequate modelfit te garanderen waren we genoodzaakt om het aantal stadia te verminderen. Ten derde specificeerden we stadium 2 met GAF-scores en ernst van psychopathologie, terwijl we de GAF-score niet gebruikten voor andere stadia. Hierdoor konden relatief hoog functionerende patiënten (GAF-scores > 70) in de hogere stadia worden ingedeeld. Het is bekend dat algemeen functioneren een voorspeller is van cognitieve prestaties en het niet-opnemen van de GAF in deze stadia (stadium 3 en 4) kan daarom onze resultaten hebben beïnvloed (Santesteban-Echarri e.a., 2017). Dit zou echter hebben geleid tot een aanzienlijk verlies van steekproefomvang en daarom hebben we ervoor gekozen om de GAF uit te sluiten bij het classificeren van deze specifieke stadia.
Wij concluderen dat er bescheiden associaties zijn tussen gevorderde ziektestadia en het werkgeheugen en de verwerkingssnelheid. Het opnemen van cognitieve parameters in het stadiëringsmodel kan de validiteit ervan enigszins verbeteren. Tegelijkertijd kunnen we ook concluderen dat andere belangrijke voorspellende factoren de overgang tussen stadia kunnen veroorzaken, en verschillende routes psychotische symptomen en cognitieve tekorten kunnen veroorzaken. Toekomstig onderzoek kan zich daarom richten op de mechanismen die verband houden met differentiële uitkomsten in cognitieve tekorten en psychopathologie. Bovendien is verder onderzoek nodig om te verhelderen welke factoren, anders dan cognitieve prestaties, bijdragen aan het voorspellen van het beloop over stadia in de loop van de tijd.
Literatuur
- Aas, I.H. (2011). Guidelines for rating Global Assessment of Functioning (GAF). Annals of General Psychiatry, 10, 2.
- Alvarez-Jimenez, M., Priede, A., Hetrick, S.E., Bendall, S., Killackey, E., Parker, A.G., McGorry, P.D. & Gleeson J.F. (2012). Risk factors for relapse following treatment for first episode psychosis: A systematic review and meta-analysis of longitudinal studies. Schizophrenia Research, 139, 116-128.
- Andreasen, N.C., Carpenter, W.T. Jr., Kane, J.M., Lasser, R.A., Marder, S.R. & Weinberger, D.R. (2005). Remission in schizophrenia: Proposed criteria and rationale for consensus. The American Journal of Psychiatry, 162, 441-449.
- Berendsen, S., Nummenin, E., Schirmbeck, F., De Haan, L., Van Tricht, M.J. & GROUP Investigators (2022). Association of cognitive performance with clinical staging in schizophrenia spectrum disorders: A prospective 6-year follow-up study. Schizophrenia Research: Cognition, [100232]. https://doi.org/10.1016/j.scog.2021.100232.
- Berendsen, S., Van, H.L., Van der Paardt, J.W., De Peuter, O.R., Van Bruggen, M., Nusselder, H., Jalink, M., Peen, J., Dekker, J.J.M. & De Haan, L. (2021). Exploration of symptom dimensions and duration of untreated psychosis within a staging model of schizophrenia spectrum disorders. Early Intervention in Psychiatry, 15(3), 669-675.
- Bora, E. & Murray, R.M. (2014). Meta-analysis of cognitive deficits in ultra-high risk to psychosis and first-episode psychosis: Do the cognitive deficits progress over, or after, the onset of psychosis? Schizophrenia Bulletin, 40, 744-755.
- Dickinson, D., Ramsey, M.E. & Gold J.M. (2007). Overlooking the obvious: A meta-analytic comparison of digit symbol coding tasks and other cognitive measures in schizophrenia. Archives of General Psychiatry, 64, 532-542.
- Firth, J., Stubbs, B., Rosenbaum, S., Vancampfort, D., Malchow, B., Schuch, F., Elliott, R., Nuechterlein, K.H. & Yung A.R. (2017). Aerobic exercise improves cognitive functioning in people with schizophrenia: A systematic review and meta-analysis. Schizophrenia Bulletin, 43, 546-556.
- Forbes, N.F., Carrick, L.A., McIntosh, A.M. & Lawrie, S.M. (2009). Working memory in schizophrenia: A meta-analysis. Psychological Medicine, 39, 889-905.
- Fusar-Poli, P., McGorry, P.D. & Kane, J.M. (2017). Improving outcomes of first-episode psychosis: An overview. World Psychiatry, 16, 251-265.
- Godin, O., Fond, G., Bulzacka, E., Schurhoff, F., Boyer, L., Myrtille, A., Andrianarisoa, M., Aouizerate, B., Berna, F., Capdevielle, D., Chereau, I., Dorey, J.M., Dubertret, C., Dubreucq, J., Faget, C., Lancon, C., Leignier, S., Mallet, J., Misdrahi, D., Passerieux, C., Rey, R., Roux, P., Vidailhet, P., Costagliola, D., Group, F.-S., Leboyer, M. & Llorca, P.M. (2019). Validation and refinement of the clinical staging model in a French cohort of outpatient with schizophrenia (FACE-SZ). Progress in Neuro-Psychopharmacology & Biological Psychiatry, 92, 226-234.
- Haan, L. de, Van Amelsvoort, T., Dingemans, P. & Linszen, D. (2007). Risk factors for medication non-adherence in patients with first episode schizophrenia and related disorders: A prospective five year follow-up. Pharmacopsychiatry, 40, 264-268.
- Husa, A.P., Moilanen, J., Murray, G.K., Marttila, R., Haapea, M., Rannikko, I., Barnett, J.H., Jones, P.B., Isohanni, M., Remes, A.M., Koponen, H., Miettunen, J. & Jääskeläinen, E. (2017). Lifetime antipsychotic medication and cognitive performance in schizophrenia at age 43 years in a general population birth cohort. Psychiatry Research, 247, 130-138.
- Kahn, R.S. & Keefe, R.S. (2013). Schizophrenia is a cognitive illness: Time for a change in focus. JAMA Psychiatry, 70, 1107-1112.
- Korver, N., Quee, P.J., Boos, H.B., Simons, C.J. & De Haan, L. (2012). Genetic risk and outcome of psychosis (GROUP), a multi-site longitudinal cohort study focused on gene-environment interaction: Objectives, sample characteristics, recruitment and assessment methods. International Journal of Methods in Psychiatric Research, 21, 205-221.
- McGorry, P.D. (2007). Issues for DSM-V: Clinical staging: A heuristic pathway to valid nosology and safer, more effective treatment in psychiatry. American Journal of Psychiatry, 164, 859-860.
- McGorry, P.D., Nelson, B., Goldstone, S. & Yung, A.R. (2010). Clinical staging: A heuristic and practical strategy for new research and better health and social outcomes for psychotic and related mood disorders. The Canadian Journal of Psychiatry, 55, 486-497.
- Omachi, Y. & Sumiyoshi, T. (2018). Dose reduction/discontinuation of antipsychotic drugs in psychosis: Effect on cognition and functional outcomes. Frontiers in Psychiatry, 9, 447. https://doi.org/10.3389/fpsyt.2018.00447.
- Peralta, V. & Cuesta, M.J. (1994). Psychometric properties of the positive and negative syndrome scale (PANSS) in schizophrenia. Psychiatry Research, 53, 31-40.
- Rund, B.R., Barder, H.E., Evensen, J., Haahr, U., Ten Velden Hegelstad, W., Joa, I., Johannessen, J.O., Langeveld, J., Larsen, T.K., Melle, I., Opjordsmoen, S., Røssberg, J.I., Simonsen, E., Sundet, K., Vaglum, P., McGlashan, T. & Friis, S. (2016). Neurocognition and duration of psychosis: A 10-year follow-up of first-episode patients. Schizophrenia Bulletin, 42, 87-95.
- Rund, B.R., Melle, I., Friis, S., Johannessen, J.O., Larsen, T.K., Midbøe, L.J., Opjordsmoen, S., Simonsen, E., Vaglum, P. & McGlashan, T. (2007). The course of neurocognitive functioning in first-episode psychosis and its relation to premorbid adjustment, duration of untreated psychosis, and relapse. Schizophrenia Research, 91, 132-140.
- Santesteban-Echarri, O., Paino, M., Rice, S., González-Blanch, C., McGorry, P., Gleeson, J. & Alvarez-Jimenez, M. (2017). Predictors of functional recovery in first-episode psychosis: A systematic review and meta-analysis of longitudinal studies. Clinical Psychology Review, 58, 59-75.
- Susser, E., Finnerty, M., Mojtabai, R., Yale, S., Conover, S., Goetz, R. & Amador, X. (2000). Reliability of the life chart schedule for assessment of the long-term course of schizophrenia. Schizophrenia Research, 42, 67-77.
- Tedja, A., Velthorst, E., Van Tricht, M. & De Haan, L. (2017). Group Preliminary validation of a clinical staging model in schizophrenia and related disorders. Clinical Schizophrenia & Related Psychoses, doi: 10.3371/CSRP.ATEV.071317.
- Ventura, J., Hellemann, G.S., Thames, A.D., Koellner, V. & Nuechterlein, K.H. (2009). Symptoms as mediators of the relationship between neurocognition and functional outcome in schizophrenia: A meta-analysis. Schizophrenia Research, 113, 189-199.
- Ventura, J., Thames, A.D., Wood, R.C., Guzik, L.H. & Hellemann, G.S. (2010). Disorganization and reality distortion in schizophrenia: A meta-analysis of the relationship between positive symptoms and neurocognitive deficits. Schizophrenia Research, 121, 1-14.
- Vita, A., Barlati, S., Ceraso, A., Nibbio, G., Ariu, C., Deste, G. & Wykes T. (2021). Effectiveness, core elements, and moderators of response of cognitive remediation for schizophrenia: A systematic review and meta-analysis of randomized clinical trials. JAMA Psychiatry, 78, 848-858.
- Weiden, P.J., Kozma, C., Grogg, A. & Locklear J. (2004). Partial compliance and risk of rehospitalization among California medicaid patients with schizophrenia. Psychiatric Services, 55, 886-891.
 © 2009-2026 Uitgeverij Boom Amsterdam
© 2009-2026 Uitgeverij Boom Amsterdam
ISSN 1871-1391
De artikelen uit de (online)tijdschriften van Uitgeverij Boom zijn auteursrechtelijk beschermd. U kunt er natuurlijk uit citeren (voorzien van een bronvermelding) maar voor reproductie in welke vorm dan ook moet toestemming aan de uitgever worden gevraagd:
Behoudens de in of krachtens de Auteurswet van 1912 gestelde uitzonderingen mag niets uit deze uitgave worden verveelvoudigd, opgeslagen in een geautomatiseerd gegevensbestand, of openbaar gemaakt, in enige vorm of op enige wijze, hetzij elektronisch, mechanisch door fotokopieën, opnamen of enig andere manier, zonder voorafgaande schriftelijke toestemming van de uitgever.
Voor zover het maken van kopieën uit deze uitgave is toegestaan op grond van artikelen 16h t/m 16m Auteurswet 1912 jo. Besluit van 27 november 2002, Stb 575, dient men de daarvoor wettelijk verschuldigde vergoeding te voldoen aan de Stichting Reprorecht te Hoofddorp (postbus 3060, 2130 KB, www.reprorecht.nl) of contact op te nemen met de uitgever voor het treffen van een rechtstreekse regeling in de zin van art. 16l, vijfde lid, Auteurswet 1912.
Voor het overnemen van gedeelte(n) uit deze uitgave in bloemlezingen, readers en andere compilatiewerken (artikel 16, Auteurswet 1912) kan men zich wenden tot de Stichting PRO (Stichting Publicatie- en Reproductierechten, postbus 3060, 2130 KB Hoofddorp, www.cedar.nl/pro).
No part of this book may be reproduced in any way whatsoever without the written permission of the publisher.
Nieuwsbrief Boom Psychologie & Psychiatrie
Meld u nu aan en ontvang maandelijks de nieuwsbrief van Boom Psychologie & Psychiatrie met aantrekkelijke aanbiedingen en de nieuwe uitgaven.
Aanmelden