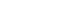Gecomputeriseerde cognitieve training bij de ziekte van Parkinson: Resultaten van de COGnitieve Training In Parkinson Studie
Samenvatting
Cognitieve achteruitgang is een veelvoorkomend, invaliderend symptoom van de ziekte van Parkinson met relatief beperkte behandelmogelijkheden. In dit artikel geven we een overzicht van de resultaten van de COGnitieve Training In Parkinson Studie: een gerandomiseerde, gecontroleerde klinische trial met als doel de effectiviteit van cognitieve training te onderzoeken. 140 mensen met de ziekte van Parkinson (Hoehn & Yahr stadium < 4) werden gerandomiseerd over een achtweekse, gecomputeriseerde cognitieve training en een actieve controleconditie. Cognitieve training had geen positief effect op onze primaire uitkomstmaat (accuratesse op een Tower of London-taak). Wij vonden een subtiele, maar consistente versnelling op executieve functietaken direct na de interventie, die echter een halfjaar na het afronden van de training niet meer aanwezig was. Bij een follow-upmeting na twee jaar waren er voorts geen verschillen tussen groepen in de ontwikkeling van parkinsondementie of lichte cognitieve stoornissen. Vooralsnog lijkt de klinische toepasbaarheid van cognitieve training daarom beperkt. Er zijn aanpassingen aan de methode en duur van de interventie nodig om de positieve effecten te vergroten en langer te behouden.
Achtergrond
De ziekte van Parkinson (parkinson) is een neurodegeneratieve ziekte die ongeveer 1 tot 3% van de mensen ouder dan zestig jaar treft (Poewe e.a., 2017; Simon e.a., 2020). De meest bekende symptomen van parkinson zijn de motorische symptomen: bradykinesie, rigiditeit en rusttremor (Postuma e.a., 2015). Echter, bij een groot deel van de mensen met parkinson komen ook niet-motorische symptomen voor, waaronder cognitieve stoornissen.
Cognitieve stoornissen zijn al bij 15 tot 24% van de mensen met parkinson aanwezig ten tijde van het stellen van de diagnose (Aarsland e.a., 2009; Muslimovic e.a., 2005; Poletti e.a., 2012). Studies met een lange follow-up hebben aangetoond dat de meerderheid van de mensen met parkinson na tien tot twintig jaar een dementie ontwikkelt (Aarsland e.a., 2017). De cognitieve stoornissen bij parkinson komen voornamelijk voor in de executieve functies, maar ook in de mentale verwerkingssnelheid, het episodisch geheugen en de visuospatiële functies. Het cognitieve profiel varieert bovendien sterk van persoon tot persoon (Greenland e.a., 2019). De stoornissen in het cognitief functioneren hebben significante negatieve gevolgen voor de kwaliteit van leven van mensen met parkinson en hun partners, en zodoende is er urgentie voor effectieve behandelvormen.
Cognitieve training als potentiële behandelvorm voor cognitieve stoornissen
Farmacologische behandeling van cognitieve stoornissen bij parkinson, bijvoorbeeld met levodopa (vroeg in de ziekte) of cholinesteraseremmers (later in het beloop) is tot op heden beperkt effectief gebleken en biedt geen bescherming tegen cognitieve achteruitgang (Svenningsson e.a., 2012; Cools, 2006; Emre e.a., 2004; Meng e.a., 2019; Robbins & Cools, 2014; Seppi e.a., 2011). Recent is er meer aandacht gekomen voor cognitieve training bij neurodegeneratieve ziektes. Grofweg kunnen twee methoden van cognitieve training worden onderscheiden: op compensatie gerichte strategietraining (zie bijvoorbeeld Vlagsma e.a., 2020) en functietraining. Cognitieve functietraining is een methode binnen de neuropsychologische revalidatie waarbij door het herhaald trainen van bepaalde cognitieve vaardigheden deze vaardigheden kunnen worden versterkt. In het vervolg van het artikel zullen wij het, wanneer we aan cognitieve training refereren, over functietraining hebben.
Bij parkinson is cognitieve training nog relatief beperkt onderzocht. In twee meta-analyses werden kleine, positieve effecten gevonden van gecomputeriseerde cognitieve training (Leung e.a., 2015; Orgeta e.a., 2020), voornamelijk met betrekking tot executieve functies, aandacht, verwerkingssnelheid en episodisch geheugen. Ook hebben twee studies aangetoond dat deze interventie mogelijk cognitieve achteruitgang op de lange termijn kan vertragen (Diez-Cirarda e.a., 2018; Petrelli e.a., 2015). Tot op heden zijn de studies echter klein in aantal geïncludeerde patiënten geweest, of ze hadden geen adequate gecontroleerde of geblindeerde designs. Ook is er tot op heden beperkt onderzoek gedaan naar de generalisatie (far transfer) van cognitieve training: de vertaling naar verbetering in het dagelijks functioneren.
Om deze reden hebben wij de COGnitieve Training In Parkinson Studie (COGTIPS) uitgevoerd: een gerandomiseerde, dubbelblind gecontroleerde klinische trial, met als doel het effect van gecomputeriseerde cognitieve training op het cognitief functioneren bij parkinson te onderzoeken. In het onderzoeksdesign hebben wij rekening gehouden met de beperkingen die in eerdere literatuuroverzichten besproken stonden. Het onderzoeksdoel was drieledig: a) het effect van een achtweekse training op het objectief gemeten en subjectief ervaren cognitief functioneren onderzoeken, b) de effecten op de lange termijn onderzoeken, en c) de effecten op structurele en functionele hersennetwerken onderzoeken. In dit artikel geven wij een overzicht van de methodologie en de effecten op cognitief functioneren van dit onderzoek. Details zijn tevens te vinden in recente publicaties/preprints (Van Balkom e.a., 2021; Van Balkom e.a., 2019; Van Balkom e.a., 2022; Vriend e.a., 2021).
Onderzoeksmethode
Aan COGTIPS namen mensen met parkinson deel die subjectieve klachten in het cognitief functioneren hadden (Parkinson's Disease Cognitive Functional Rating Scale (PD-CFRS) > 3), maar geen indicatie voor parkinsondementie (Montreal Cognitive Assessment ≥ 22) of ernstige somberheid hadden (Beck Depression Inventory ≤ 18).
De participanten werden 1:1 gerandomiseerd over de cognitieve trainingsgroep en een actieve controlegroep. In beide condities werden zelfstandig 24 trainingssessies uitgevoerd op de website van BrainGymmer (Dezzel Media B.V.) in acht weken tijd, elk met een duur van ongeveer 45 minuten. Therapietrouw werd digitaal gemonitord en er waren tweewekelijkse telefonische contactmomenten om eventuele vragen te beantwoorden. De cognitieve trainingsgroep onderging elke sessie dertien trainingsspellen, gefocust op executieve functies, mentale snelheid, aandacht en visuospatiële functies, die cognitief uitdagend waren en gedurende de training aangepast werden aan het niveau van de individuele deelnemer. Voorbeelden zijn een spel waarbij verschillende bewegende targetstimuli (konijnen met wortel) moesten worden gevolgd, omringd door afleiders (verdeelde aandacht) en een regel-wisseltaak oplopend in snelheid (boodschappenitems kiezen waarbij het te kiezen item verandert). De actieve controlegroep voerde elke sessie hetzelfde uit: achtereenvolgens patience, galgje en triviavragen. Zowel participanten als onderzoekers die het neuropsychologisch onderzoek uitvoerden, waren blind voor de conditie die was toegewezen. Deelnemers hadden geen kennis over de verschillen tussen condities.
De participanten ondergingen vijfmaal neuropsychologisch onderzoek: op baseline (T0), na de interventie (T1), en een halfjaar (T2), een jaar (T3) en twee jaar (T4) na het stoppen met de interventie. Bij elke meting werden minstens twee neuropsychologische tests per cognitief domein ingezet (zie Box 1, p. 5). De neuropsychologische uitkomstmaten waren zelf geen onderdeel van de cognitieve training. Cognitieve disfunctie werd geobjectiveerd door resultaten van het neuropsychologisch onderzoek om te zetten in T-scores (Campo & Morales, 2003; Kessels e.a., 2016; Nicholas e.a., 1989; Schmand e.a., 2012) en deze data werden gebruikt om participanten volgens de diagnostische criteria van de Movement Disorders Society te classificeren met normale cognitie, mild cognitive impairment (MCI) of dementie (Emre e.a., 2007; Litvan e.a., 2012). We gebruikten verandering van deze classificatie als een maat voor cognitieve achteruitgang. Ook vulden participanten vragenlijsten in over het subjectief cognitief functioneren en psychiatrische symptomen, en ondergingen zij een neurologisch onderzoek (voor een gedetailleerd overzicht zie Van Balkom e.a., 2019). De tijdslijn is weergegeven in Figuur 1.
Box 1 Overzicht van uitkomstmaten
| Neuropsychologisch testonderzoek | Tower of London (primaire uitkomstmaat) |
|---|---|
| Montreal Cognitive Assessment | |
| Pentagon kopie | |
| Stroop Kleur-Woord Test | |
| COWAT ('letterfluency')* | |
| WAIS-III cijferreeksen | |
| 15-Woordentest* | |
| Location Learning Test* | |
| Boston benoemtaak | |
| Categoriefluency | |
| Complexe Figuur van Rey | |
| Visual Form Discrimination Test | |
| Subjectieve klachten in het cognitief functioneren | Parkinson's disease – Cognitive Functional Rating Scale |
| Cognitive Failures Questionnaire | |
| Vragenlijsten psychiatrische symptomen | Beck Depression Inventory |
| Apathy Scale | |
| Parkinson Anxiety Scale | |
| Questionnaire for Impulsive-Compulsive Disorders in Parkinson's Disease – Rating Scale | |
| Andere uitkomstmaten | Unified Parkinson's Disease Rating Scale III – motor score |
| Hoehn & Yahr ziektestadium | |
| New Zealand Physical Activity Questionnaire – Short Form | |
| Cognitive Reserve Index Questionnaire | |
| Credibility/Expectancy Questionnaire |
*Parallelversies
Figuur 1 Tijdslijn van het onderzoek
De primaire uitkomst van COGTIPS was de accuratesse op een gecomputeriseerde Tower of London-taak (Trujillo e.a., 2015), die verschillende componenten van het executief functioneren meet, met de focus op het planningsvermogen (Bouma e.a., 2012). Deze uitkomst was gekozen omdat de cognitieve training zich richtte op de executieve functies en de studiepopulatie doorgaans primair disfuncties op dit domein laat zien. De gecomputeriseerde versie van de Tower of London is zeer vergelijkbaar met reguliere versies uit de klinische praktijk, maar de stappen moeten volledig in gedachten worden uitgevoerd en de test bestaat uit honderd items met een moeilijkheid variërend van één stap (S1, relatief gemakkelijk) tot vijf stappen (S5, complex). Eerder onderzoek heeft laten zien dat mensen met de ziekte van Parkinson meetbare achteruitgang op deze versie van de Tower of London laten zien (Trujillo e.a., 2015). Andere neuropsychologische tests waren secundaire uitkomstmaten, alsmede vragenlijsten betreffende subjectieve cognitieve klachten en psychiatrische symptomen.
Om het effect van de training te onderzoeken gebruikten we lineaire mixed-modelanalyses met de primaire en secundaire uitkomstmaten als afhankelijke variabele, waarbij we conditie als onafhankelijke variabele en baselinefunctioneren als covariaat modelleerden. De langetermijneffecten analyseerden we door de factor 'tijd' (T1-T4) aan de hierboven beschreven modellen toe te voegen. Aanvullend onderzochten we cognitieve achteruitgang met Fisher's exact tests en bijbehorende odds ratio's.
Effect van cognitieve training
Participanten
140 mensen met parkinson namen deel aan het onderzoek. Vier participanten bleken retrospectief gezien niet aan de inclusiecriteria te voldoen en zijn daarom niet meegenomen in de analyses. Bij baseline waren er subtiele, zij het niet-significante groepsverschillen op het gebied van geslacht, aantal jaren opleiding en klachten in het denkvermogen. Demografische en klinische gegevens bij baseline zijn weergegeven in Tabel 1 (p. 7).
Tabel 1 Demografische en klinische gegevens van de sample bij baseline
| Actieve controle (N = 68) | Cognitieve training (N = 68) | |
|---|---|---|
| Geslacht (N vrouw (%)) | 21 (31%) | 33 (49%) |
| Leeftijd (jaren) | 62,9 (7,0) | 62,9 (8,1) |
| Opleiding (jaren) | 16,7 (4,4) | 15,5 (3,3) |
| Opleiding (Verhage, mediaan [bereik]) | 6 [3-7] | 6 [3-7] |
| Ziekteduur (jaren, mediaan [bereik]) | 5 [1-26] | 5 [0-22] |
| UPDRS-III | 21,0 (9,5) | 20,2 (8,3) |
| Hoehn & Yahr stadium (N (%)) | ||
| 1 | 5 (7,4%) | 4 (5,9%) |
| 1,5 | 2 (2,9%) | 7 (10,3%) |
| 2 | 34 (50,0%) | 28 (41,2%) |
| 2,5 | 18 (26,5%) | 18 (26,5%) |
| 3 | 9 (13,2%) | 11 (16,2%) |
| LEDD (mediaan [bereik]) | 650 [0-2100] | 737 [0-1665] |
| MoCA | 25,9 (2,3) | 26,3 (2,0) |
| Cognitieve status (N (%)) | ||
| Normale cognitie | 13 (19,1%) | 15 (22,1%) |
| MCI | 42 (61,8%) | 43 (63,2%) |
| Dementie | 13 (19,1%) | 10 (14,7%) |
| BDI | 7,87 (4,1) | 8,21 (4,0) |
| QUIP-RS (N = 125) | 19,2 (12,7) | 15,8 (12,8) |
| PAS (N = 135) | 10,5 (6,8) | 10,3 (6,6) |
| AS (N = 135) | 13,4 (4,5) | 13,2 (4,5) |
| PD-CFRS (mediaan [bereik]) | 9,0 [3,3-22] | 7,0 [3,3-19] |
| Therapietrouw (%, mediaan [bereik]) | 100 [25-100] | 100 [39-100] |
Data zijn weergegeven als gemiddelde (standaarddeviatie) tenzij anders vermeld. Afkortingen: AS = Apathy Scale; BDI = Beck Depression Inventory; PAS = Parkinson Anxiety Scale; PD-CFRS = Parkinson's Disease – Cognitive Functional Rating Scale; LEDD = Levodopa equivalent daily dosage; MCI = mild cognitive impairment; MoCA = Montreal Cognitive Assessment; QUIP-RS = Questionnaire for Impulsive-Compulsive Disorders in Parkinson's Disease – Rating Scale; UPDRS = Unified Parkinson's Disease Rating Scale.
Directe effecten van cognitieve training
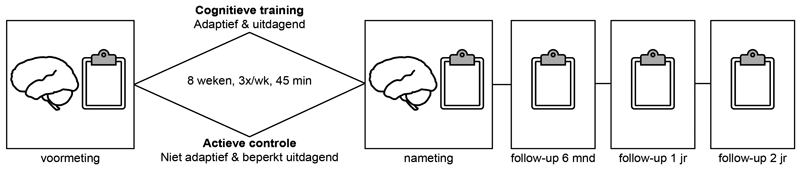
Allereerst onderzochten we of participanten verbeterden op de trainingsspellen die zij gedurende hun training uitvoerden. In beide condities zagen we dat de prestaties op de individuele trainingsspellen duidelijk toenamen. De scores zijn echter niet te vergelijken tussen interventies in verband met de verschillende inhoud van de twee condities. De verbetering is weergegeven in Figuur 2 (p. 8).
Figuur 2 Verbetering op de cognitieve training (A) en de actieve controleconditie (B). Datapunten zijn gemiddelde Z-scores met de standaardfout als onzekerheidsmarge. De lichte lijnen geven de scores op de individuele trainingsspellen weer. Afkortingen: AC = actieve controleconditie; CT = cognitieve training.
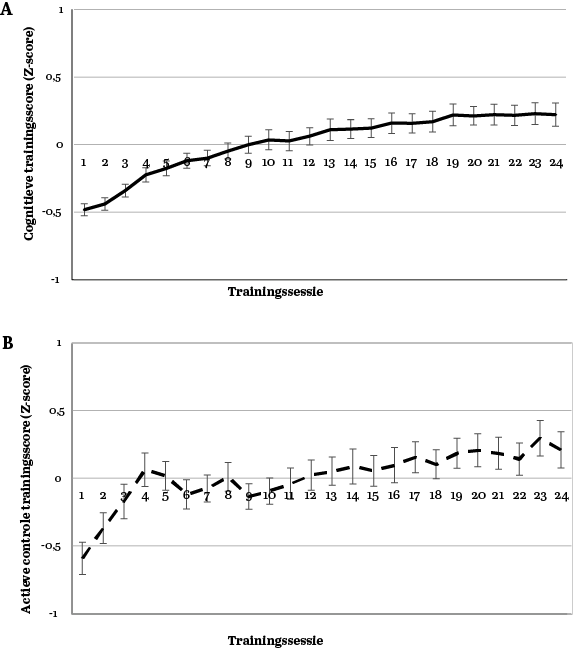
De cognitieve training had geen positieve effecten op executieve functies als gemeten met de accuratesse op de Tower of London – de primaire uitkomstmaat (Figuur 3A, p. 10). Zowel de cognitieve trainings- als actieve controlegroep presteerden na de interventie gemiddeld iets beter dan voor de interventie (Figuur 2). De cognitieve training leek positieve effecten te hebben op de responstijd op deze taak: we zagen dat de cognitieve trainingsgroep 0,17 standaarddeviatie sneller was na de interventie ten opzichte van de actieve controlegroep. Hoewel dit effect overall trend-significant was, vonden we wel een statistisch significant verschil tussen groepen voor de meer complexe items (taakmoeilijkheid S4) van de Tower of London, waarop de cognitieve trainingsgroep na de interventie 1,5 seconden (0,28 standaarddeviatie) sneller was dan de actieve controlegroep (Figuur 3B, p. 10). De effecten op de andere taakitems van de Tower of London waren ook in het voordeel van de cognitieve training, maar niet statistisch significant.
Wat betreft de andere neuropsychologische taken leek cognitieve training subtiele positieve effecten te hebben op de Stroop Kleur-Woord Test (Figuur 3C, p. 10), die echter niet standhielden na correctie voor multipele vergelijkingen. Op andere cognitieve domeinen had de cognitieve training geen positief effect ten opzichte van de actieve controleconditie. Versnelling op de Tower of London en Stroop Kleur-Woord Test correleerde met verbetering op diverse trainingsspellen uit de cognitieve training. Een post-hocanalyse van de effecten op de Tower of London en Stroop Kleur-Woord Test liet zien dat de effecten van cognitieve training relatief groter waren bij de mensen die voldeden aan de diagnostische criteria van parkinsondementie ten opzichte van de andere twee subgroepen.
Op subjectieve cognitieve klachten waren na interventie geen groepsverschillen aanwezig. Beide groepen ervoeren na de interventie minder klachten in het denkvermogen.
Langetermijneffecten
De effecten die direct na de interventie aanwezig waren, hielden geen stand. Bij de drie follow-upmetingen waren de effecten op de responstijd van de Tower of London niet meer aanwezig, noch op de Stroop Kleur-Woord Kaart (zie Figuur 3A-C). Ook was er geen verschil tussen condities in cognitieve achteruitgang. Beide groepen hadden een vergelijkbare kans om cognitief achteruit te gaan ten opzichte van baseline. Hierbij valt op dat het grootste deel van de onderzoekspopulatie stabiel bleef gedurende de studie en dat het deel dat achteruitgang liet zien, even groot was als het deel dat vooruitgang toonde ten opzichte van baseline (Figuur 3D).
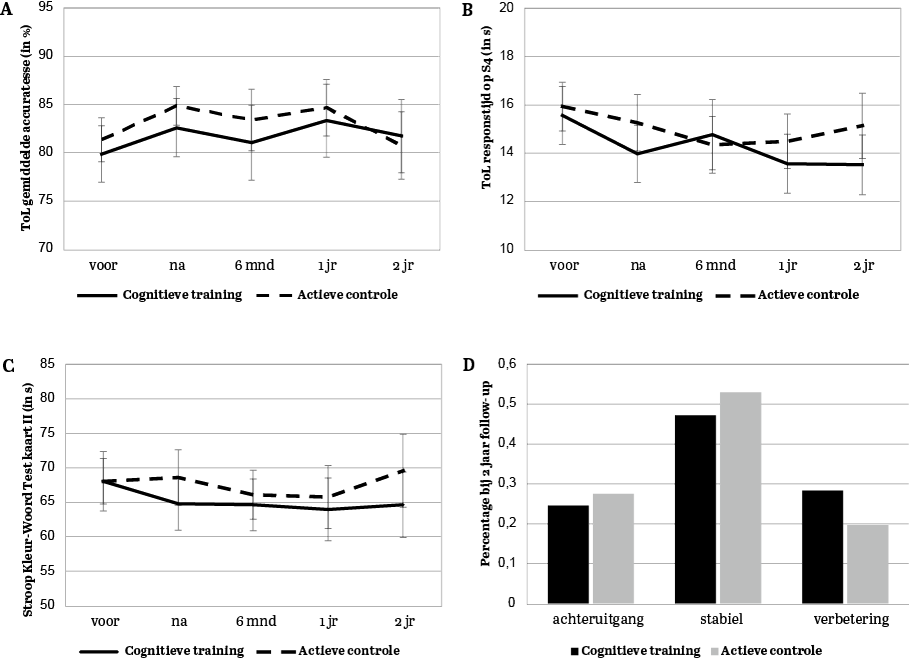
Figuur 3 Verandering over tijd op de Tower of London (ToL) accuratesse (A), responstijd van moeilijkheidsniveau S4 (B), Stroop Kleur-Woord Test kaart II (C). De directe interventie-effecten die op paneel B en C bij de nameting te zien zijn ('na'), zijn bij de follow-upmetingen niet meer aanwezig. Paneel D toont de verandering in cognitieve status (dat wil zeggen, normale cognitie, MCI of dementie) twee jaar na het stoppen met de training. Punten in de lijngrafieken zijn gemiddelden met standaardfout.
Discussie
De behandelmogelijkheden voor cognitieve stoornissen bij parkinson zijn nog zeer beperkt, terwijl deze de kwaliteit van leven fors negatief beïnvloeden. Met COGTIPS hebben wij getracht de effecten van cognitieve training te onderzoeken door een gerandomiseerd, gecontroleerd onderzoeksdesign in een relatief grote onderzoeksgroep. Hoewel onze achtweekse cognitieve training subtiele positieve effecten had op de mentale verwerkingssnelheid op twee executieve functietaken (waarvan een niet significant na correctie voor aantal vergelijkingen), vertaalden deze effecten zich niet naar de subjectieve beleving en hielden de effecten geen stand bij follow-up.
De effecten die onze studie heeft aangetoond zijn in overeenstemming met de bestaande literatuur, met kleine tot middelgrote effecten op mentale verwerkingssnelheid (d ≈ .30). Echter, wij konden effecten op andere domeinen alsmede langetermijneffecten niet repliceren (Diez-Cirarda e.a., 2018; Leung e.a., 2015; Orgeta e.a., 2020; Petrelli e.a., 2015). Enerzijds kan dit te maken hebben met methodologische beperkingen van eerdere studies, waaronder kleine groepsgroottes, geen of passieve controlegroepen, of geen of onduidelijke blindering. Anderzijds is er tot op heden geen richtlijn waar cognitieve training uit zou moeten of kunnen bestaan, waardoor interventies fors kunnen verschillen en zodoende uiteenlopende effecten kunnen hebben. Voor het veld zal het interessant zijn de resultaten van andere lopende trials te integreren met de resultaten van ons onderzoek (zie bijvoorbeeld: Van de Weijer e.a., 2016; Van de Weijer e.a., 2020). Samengenomen kunnen we stellen dat cognitieve functietraining positieve, maar in grootte beperkte effecten lijkt te hebben en dat de interventie in deze intensiteit, vorm en duur niet voldoende is om cognitieve stoornissen te behandelen in de huidige klinische praktijk.
Post-hocanalyses lieten zien dat de effecten van cognitieve training het meest uitgesproken waren bij een subgroep die voldeed aan de diagnostische criteria van parkinsondementie (Emre e.a., 2007). Een mogelijke verklaring voor dit resultaat kan zijn dat er in deze subgroep meer ruimte voor verbetering op neuropsychologische tests is, terwijl dit bijvoorbeeld bij mensen die op gezond niveau presteren, minder het geval is. Vanwege de beperkte grootte van de subgroep van mensen met dementie moeten deze effecten echter met voorzichtigheid worden geïnterpreteerd. Voorts leken effecten zich niet te generaliseren naar de subjectieve beleving van cognitieve klachten. Een van de twee uitkomstmaten die wij gebruikten voor het meten van subjectieve cognitieve klachten – de PD-CFRS –, is een voor parkinson gevalideerde vragenlijst die specifiek gaat over problemen die frequent bij parkinson voorkomen (Kulisevsky e.a., 2013). De vragenlijst is gevoelig voor het meten van cognitieve achteruitgang, maar de sensitiviteit voor het omgekeerde effect is vooralsnog niet onderzocht. Een alternatief dat mogelijk beter zou kunnen aansluiten bij het meten van persoonlijke verandering in subjectieve klachten is het gebruik van goal attainment scaling: individuele, SMART geformuleerde behandeldoelen die op een vijfpuntsschaal kunnen worden beoordeeld (Lannin, 2003).
Op grond van onze resultaten lijkt cognitieve training in de huidige vorm onvoldoende effectief om als behandelvorm te worden ingezet. Tot nog toe laat cognitieve training namelijk enkel near transfer zien – verbetering op neuropsychologische tests – en vertalen deze zich niet in far transfer: klinisch waardevolle effecten in het dagelijks leven. Vervolgonderzoek is noodzakelijk om te onderzoeken of cognitieve training in aangepaste vorm wel klinisch inzetbaar kan zijn. Eén optie is het intensiveren of verlengen van de interventie: er is bijvoorbeeld evidentie dat boostersessies – herhaling van cognitieve training na enkele maanden – effecten van cognitieve training kunnen verlengen (Felix e.a., 2021). Tevens is er meer aandacht voor multimodale interventies, waarbij cognitieve training bijvoorbeeld wordt gecombineerd met strategietraining (Vlagsma e.a., 2020), aerobe fysieke activiteit (Ten Brinke e.a., 2020) of neurostimulatie (Lawrence e.a., 2018). Om cognitieve training meer aan te laten sluiten bij het dagelijks leven lijkt gebruik van virtual reality een interessante optie, daar deze de voordelen bezit van gecomputeriseerde cognitieve training: het kan laagdrempelig, gestandaardiseerd en vanuit huis worden aangeboden.
Enkele beperkingen van ons onderzoek dienen in acht te worden genomen bij de interpretatie van de resultaten. We gebruikten een actieve controleconditie om te corrigeren voor aspecifieke cognitieve activiteit, maar kunnen niet uitsluiten dat deze conditie zelf ook enig effect heeft gehad. Een wachtlijstconditie had hier meer uitsluitsel over kunnen geven. Verder hadden wij geen uitkomstmaat voor participatie, enkel voor subjectieve beleving van het cognitief functioneren – al is het op basis van de resultaten niet aannemelijk dat er verbetering in participatie heeft plaatsgevonden. Tot slot vonden we meer variatie in cognitief functioneren in onze onderzoeksgroep dan verwacht, met een subgroep die voldeed aan de criteria voor een parkinsondementie ondanks het inclusiecriterium op de MoCA. Zoals onze post-hocanalyse suggereert, kan deze heterogeniteit meer onzekerheid over de effecten geven. De observatie dat de cognitieve training effectiever lijkt te zijn bij cognitief aangedane patiënten dient te worden gerepliceerd gezien de beperkte grootte van deze subgroep.
Samengevat lijkt onze achtweekse, gecomputeriseerde cognitieve training subtiele positieve effecten te hebben op neuropsychologische tests die mentale verwerkingssnelheid meten, echter vooralsnog zonder vertaling naar effecten op subjectieve klachten. Bovendien geven de resultaten van COGTIPS geen aanwijzingen voor langetermijneffecten van cognitieve training. Verbeteringen van de cognitieve trainingsmethode of multimodale interventies, maar ook ontwikkeling van andere behandelmethoden zijn nodig om toe te kunnen werken naar een effectieve en geschikte niet-medicamenteuze behandelvorm voor cognitieve stoornissen bij de ziekte van Parkinson.
Relevante publicaties betreffende COGTIPS
Indien u graag meer wilt lezen over COGTIPS, verwijzen wij u graag naar onderstaande publicaties waar de resultaten in meer detail beschreven staan. Ook kunt u hier meer informatie vinden over de resultaten van het hersenscanonderzoek (Van Balkom e.a., 2022; Vriend e.a., 2021).
Balkom, T.D. van, Berendse, H.W., Van der Werf, Y.D., Twisk, J.W.R., Peeters, C.F.W., Hagen, R.H. e.a. (2021). Effect of eight-week online cognitive training in Parkinson's disease: A randomized controlled trial. medRxiv.
Balkom, T.D. van, Berendse, H.W., Van der Werf, Y.D., Twisk, J.W.R., Zijlstra, I., Hagen, R.H. e.a. (2019). COGTIPS: A double-blind randomized active controlled trial protocol to study the effect of home-based, online cognitive training on cognition and brain networks in Parkinson's disease. BMC Neurology, 19(1), 179.
Balkom, T.D. van, Van den Heuvel, O.A., Berendse, H.W., Van der Werf, Y.D., & Vriend, C. (2022). Eight-week multi-domain cognitive training does not impact large-scale resting-state brain networks in Parkinson's disease. NeuroImage: Clinical, 33, 102952.
Vriend, C., Van Balkom, T.D., Berendse, H.W., Van der Werf, Y.D. & Van den Heuvel, O.A. (2021). Cognitive training in Parkinson's disease induces local, not global, changes in white matter microstructure. Neurotherapeutics, https://doi.org/10.1007/s13311-021-01103-9.
Dankbetuiging
De onderzoekers bedanken de stagiaires van COGTIPS voor hun grenzeloze inzet en de gebruikerscommissie voor de waardevolle discussies over de interpretatie en toepassing van de onderzoeksresultaten. Het onderzoek werd gefinancierd door beurzen van de Hersenstichting (beurs HA-2017-00227) en de Parkinson Vereniging (beurs 2015-R04). De werving van het onderzoek is uitgevoerd met hulp van Hersenonderzoek, een Nederlands online register dat werving voor neurowetenschappelijk onderzoek vergemakkelijkt (www.hersenonderzoek.nl). Hersenonderzoek.nl is gesubsidieerd door ZonMw-Memorabel (projectnummer 73305095003), een project in de context van het Nederlandse Deltaplan Dementie, Gieskes-Strijbis Fonds, Alzheimer Nederland en de Hersenstichting. Participanten werden tevens geworven via ParkinsonNEXT, een online register dat tot doel heeft patiënten, onderzoekers en clinici die deel willen nemen aan onderzoek en innovatie op het gebied van de ziekte van Parkinson en parkinsonismen samen te brengen. ParkinsonNEXT geeft informatie over lopende studies en faciliteert werving.
Literatuur
- Aarsland, D., Bronnick, K., Larsen, J.P., Tysnes, O.B. & Alves, G. (2009). Cognitive impairment in incident, untreated Parkinson disease: The Norwegian ParkWest Study. Neurology, 72(13), 1121-1126.
- Aarsland, D., Creese, B., Politis, M., Chaudhuri, K.R., Ffytche, D.H., Weintraub, D. e.a. (2017). Cognitive decline in Parkinson disease. Nature Reviews Neurology, 13(4), 217-231.
- Balkom, T.D. van, Berendse, H.W., Van der Werf, Y.D., Twisk, J.W.R., Peeters, C.F.W., Hagen, R.H. e.a. (2021). Effect of eight-week online cognitive training in Parkinson's disease: A randomized controlled trial. medRxiv.
- Balkom, T.D. van, Berendse, H.W., Van der Werf, Y.D., Twisk, J.W.R., Zijlstra, I., Hagen, R.H. e.a. (2019). COGTIPS: A double-blind randomized active controlled trial protocol to study the effect of home-based, online cognitive training on cognition and brain networks in Parkinson's disease. BMC Neurology, 19(1), 179.
- Balkom, T.D. van, Van den Heuvel, O.A., Berendse, H.W., Van der Werf, Y.D., Vriend, C. (2022). Eight-week multi-domain cognitive training does not impact large-scale resting-state brain networks in Parkinson's disease. NeuroImage: Clinical, 33, 102952.
- Bouma, A., Mulder, J., Lindeboom, J. & Schmand, B. (2012). Handboek neuropsychologische diagnostiek, 2e ed. Amsterdam: Pearson.
- Brinke, L.F. ten, Best, J.R., Chan, J.L.C., Ghag, C., Erickson, K.I., Handy, T.C. e.a. (2020). The effects of computerized cognitive training with and without physical exercise on cognitive function in older adults: An 8-week randomized controlled trial. Journals of Gerontology Series a-Biological Sciences and Medical Sciences, 75(4), 755-763.
- Campo, P. & Morales, M. (2003). Reliability and normative data for the Benton Visual Form Discrimination Test. The Clinical Neuropsychologist, 17(2), 220-225.
- Cools, R. (2006). Dopaminergic modulation of cognitive function-implications for l-dopa treatment in Parkinson's disease. Neuroscience & Biobehavioral Reviews, 30, 1-23.
- Diez-Cirarda, M., Ojeda, N., Pena, J., Cabrera-Zubizarreta, A., Lucas-Jimenez, O., Gomez-Esteban, J.C. e.a. (2018). Long-term effects of cognitive rehabilitation on brain, functional outcome and cognition in Parkinson's disease. European Journal of Neurology, 25(1), 5-12.
- Emre, M., Aarsland, D., Albanese, A., Byrne, E.J., Deuschl, G., De Deyn, P.P. e.a. (2004). Rivastigmine for dementia associated with Parkinson's disease. New England Journal of Medicine, 351(24), 2509-2518.
- Emre, M., Aarsland, D., Brown, R., Burn, D.J., Duyckaerts, C., Mizuno, Y. e.a. (2007). Clinical diagnostic criteria for dementia associated with Parkinson's disease. Movement Disorders, 22(12), 1689-1707.
- Felix, L.M., Mansur-Alves, M., Teles, M., Jamison, L. & Golino, H. (2021). Longitudinal impact and effects of booster sessions in a cognitive training program for healthy older adults. Archives of Gerontology and Geriatrics, 94, 104337.
- Greenland, J.C., Williams-Gray, C.H. & Barker, R.A. (2019). The clinical heterogeneity of Parkinson's disease and its therapeutic implications. European Journal of Neuroscience, 49(3), 328-338.
- Kessels, R.P.C., Bucks, R.S., Willison, R.W. & Byrne, L.M.T. (2016). Location Learning Test: Handleiding, 4e ed. Amsterdam: Hogrefe.
- Kulisevsky, J., Fernandez de Bobadilla, R., Pagonabarraga, J., Martinez-Horta, S., Campolongo, A., Garcia-Sanchez, C. e.a. (2013). Measuring functional impact of cognitive impairment: Validation of the Parkinson's disease cognitive functional rating scale. Parkinsonism & Related Disorders, 19(9), 812-817.
- Lannin, N. (2003). Goal attainment scaling allows program evaluation of a home-based occupational therapy program. Occupational Therapy in Health Care, 17(1), 43-54.
- Lawrence, B.J., Gasson, N., Johnson, A.R., Booth, L. & Loftus, A.M. (2018). Cognitive training and transcranial direct current stimulation for mild cognitive impairment in Parkinson's disease: A randomized controlled trial. Parkinson's Disease, 2018, 4318475.
- Leung, I.H., Walton, C.C., Hallock, H., Lewis, S.J., Valenzuela, M. & Lampit, A. (2015). Cognitive training in Parkinson disease: A systematic review and meta-analysis. Neurology, 85(21), 1843-1851.
- Litvan, I., Goldman, J.G., Troster, A.I., Schmand, B.A., Weintraub, D., Petersen, R.C. e.a. (2012). Diagnostic criteria for mild cognitive impairment in Parkinson's disease: Movement disorder society task force guidelines. Movement Disorders, 27(3), 349-356.
- Meng, Y.H., Wang, P.P., Song, Y.X. & Wang, J.H. (2019). Cholinesterase inhibitors and memantine for Parkinson's disease dementia and lewy body dementia: A meta-analysis. Experimental and Therapeutic Medicine, 17(3), 1611-1624.
- Muslimovic, D., Post, B., Speelman, J.D. & Schmand, B. (2005). Cognitive profile of patients with newly diagnosed Parkinson disease. Neurology, 65(8), 1239-1245.
- Nicholas, L.E., Brookshire, R.H., Maclennan, D.L., Schumacher, J.G. & Porrazzo, S.A. (1989). Revised administration and scoring procedures for the Boston Naming Test and norms for non-brain-damaged adults. Aphasiology, 3(6), 569-580.
- Orgeta, V., McDonald, K.R., Poliakoff, E., Hindle, J.V., Clare, L. & Leroi, I. (2020). Cognitive training interventions for dementia and mild cognitive impairment in Parkinson's disease. Cochrane Database of Systematic Reviews, 2, CD011961.
- Petrelli, A., Kaesberg, S., Barbe, M.T., Timmermann, L., Rosen, J.B., Fink, G.R. e.a. (2015). Cognitive training in Parkinson's disease reduces cognitive decline in the long term. European Journal of Neurology, 22(4), 640-647.
- Poewe, W., Seppi, K., Tanner, C.M., Halliday, G.M., Brundin, P., Volkmann, J. e.a. (2017). Parkinson disease. Nature Reviews Disease Primers, 3, 17013.
- Poletti, M., Frosini, D., Pagni, C., Baldacci, F., Nicoletti, V., Tognoni, G. e.a. (2012). Mild cognitive impairment and cognitive-motor relationships in newly diagnosed drug-naive patients with Parkinson's disease. Journal of Neurology, Neurosurgery, and Psychiatry, 83(6), 601-606.
- Postuma, R.B., Berg, D., Stern, M., Poewe, W., Olanow, C.W., Oertel, W. e.a. (2015). Mds clinical diagnostic criteria for Parkinson's disease. Movement Disorders, 30(12), 1591-1601.
- Robbins, T.W. & Cools, R. (2014). Cognitive deficits in Parkinson's disease: A cognitive neuroscience perspective. Movement Disorders, 29, 597-607.
- Schmand, B., Houx, P. & De Koning, I. (2012). Normen voor neuropsychologisch onderzoek. Verkrijgbaar op https://www.psynip.nl/en/.
- Seppi, K., Weintraub, D., Coelho, M., Perez-Lloret, S., Fox, S.H., Katzenschlager, R. e.a. (2011). The movement disorder society evidence-based medicine review update: Treatments for the non-motor symptoms of Parkinson's disease. Movement Disorders, 26 Suppl 3, S42-80.
- Simon, D.K., Tanner, C.M. & Brundin, P. (2020). Parkinson disease epidemiology, pathology, genetics, and pathophysiology. Clinics in Geriatric Medicine, 36(1), 1-12.
- Svenningsson, P., Westman, E., Ballard, C. & Aarsland, D. (2012). Cognitive impairment in patients with Parkinson's disease: Diagnosis, biomarkers, and treatment. The Lancet Neurology, 11(8), 697-707.
- Trujillo, J.P., Gerrits, N.J., Vriend, C., Berendse, H.W., Van den Heuvel, O.A. & Van der Werf, Y.D. (2015). Impaired planning in Parkinson's disease is reflected by reduced brain activation and connectivity. Human Brain Mapping, 36(9), 3703-3715.
- Weijer, S.C. van de, Duits, A.A., Bloem, B.R., Kessels, R.P., Jansen, J.F., Kohler, S. e.a. (2016). The parkin'play study: Protocol of a phase II randomized controlled trial to assess the effects of a health game on cognition in Parkinson's disease. BMC Neurology, 16(1), 209.
- Weijer, S.C.F. van de, Duits, A.A., Bloem, B.R., De Vries, N.M., Kessels, R.P.C., Kohler, S. e.a. (2020). Feasibility of a cognitive training game in Parkinson's disease: The randomized parkin'play study. European Neurology, 83(4), 426-432.
- Vlagsma, T.T., Duits, A.A., Dijkstra, H.T., Van Laar, T. & Spikman, J.M. (2020). Effectiveness of reset: A strategic executive treatment for executive dysfunctioning in patients with Parkinson's disease. Neuropsychological Rehabilitation, 30(1), 67-84.
- Vriend, C., Van Balkom, T.D., Berendse, H.W., Van der Werf, Y.D. & Van den Heuvel, O.A. (2021). Cognitive training in Parkinson's disease induces local, not global, changes in white matter microstructure. Neurotherapeutics, https://doi.org/10.1007/s13311-021-01103-9.
 © 2009-2026 Uitgeverij Boom Amsterdam
© 2009-2026 Uitgeverij Boom Amsterdam
ISSN 1871-1391
De artikelen uit de (online)tijdschriften van Uitgeverij Boom zijn auteursrechtelijk beschermd. U kunt er natuurlijk uit citeren (voorzien van een bronvermelding) maar voor reproductie in welke vorm dan ook moet toestemming aan de uitgever worden gevraagd:
Behoudens de in of krachtens de Auteurswet van 1912 gestelde uitzonderingen mag niets uit deze uitgave worden verveelvoudigd, opgeslagen in een geautomatiseerd gegevensbestand, of openbaar gemaakt, in enige vorm of op enige wijze, hetzij elektronisch, mechanisch door fotokopieën, opnamen of enig andere manier, zonder voorafgaande schriftelijke toestemming van de uitgever.
Voor zover het maken van kopieën uit deze uitgave is toegestaan op grond van artikelen 16h t/m 16m Auteurswet 1912 jo. Besluit van 27 november 2002, Stb 575, dient men de daarvoor wettelijk verschuldigde vergoeding te voldoen aan de Stichting Reprorecht te Hoofddorp (postbus 3060, 2130 KB, www.reprorecht.nl) of contact op te nemen met de uitgever voor het treffen van een rechtstreekse regeling in de zin van art. 16l, vijfde lid, Auteurswet 1912.
Voor het overnemen van gedeelte(n) uit deze uitgave in bloemlezingen, readers en andere compilatiewerken (artikel 16, Auteurswet 1912) kan men zich wenden tot de Stichting PRO (Stichting Publicatie- en Reproductierechten, postbus 3060, 2130 KB Hoofddorp, www.cedar.nl/pro).
No part of this book may be reproduced in any way whatsoever without the written permission of the publisher.
Nieuwsbrief Boom Psychologie & Psychiatrie
Meld u nu aan en ontvang maandelijks de nieuwsbrief van Boom Psychologie & Psychiatrie met aantrekkelijke aanbiedingen en de nieuwe uitgaven.
Aanmelden